判断溶液中阴阳离子的存在情况。
几种常见离子的检验
| 离子 | 所用试剂 | 方法 | 现象 | 化学方程式 |
| Cl- | AgNO3溶液和稀HNO3 | 将AgNO3溶液滴入待测液中,再加稀HNO3 | 生成白色沉淀.且不溶于稀HNO3 | AgNO3+NaCl==AgCl↓+NaNO3 |
| SO42- | BaCl2溶液和稀盐酸 | 将稀盐酸滴入待测液中,再加BaCl2溶液 | 滴加稀盐酸无现象,滴加 BaCl2溶液生成白色沉淀,且沉淀不溶于稀盐酸 | BaCl2+Na2SO4==BaSO4↓+ +2NaCl |
| CO32- | 盐酸(或HNO3) 和澄清石灰水 | 向待测液中加入盐酸(或HNO3).将产生的气体通入澄清石灰水中 | 产生无色无味的气体,此气体能使澄清的石灰水变浑浊 | Na2CO3+2HCl==2NaCl+H2O+ CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O |
| OH- | 酚酞试液、紫色石蕊试液或红色石蕊试纸 | ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 | ①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 | ?? |
| H+ | 紫色石蕊试液或蓝色石蕊试纸 | ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 | ①溶液变红 ②蓝色石蕊试纸变红 | ?? |
| NH4+ | 浓NaOH溶液 | 将浓NaOH溶液加入待测液中,加热,将湿润的红色石蕊试纸置于试管口(或用玻璃棒蘸浓盐酸置于试管口) | 放出有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝(或遇到浓盐酸产生大量白烟) | NH4Cl+NaOH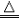 NaCl+H2O+NH3↑ NaCl+H2O+NH3↑ |
| Cu2+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | CuSO4+2NaOH==Cu(OH)2↓ |
| Fe3+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | FeCl3+3NaOH==Fe(OH)3↓+3NaCl |
常见酸、碱、盐的检验:
| 物质 | 检验方法 | 实验现象 | 典型化学式 |
| 硫酸及可溶性硫酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人稀盐酸和BaCl2溶液[或 Ba(NO3)2溶液] | (1)溶液变红 (2)加入稀盐酸无明显现象,再加入BaCl2溶液有自色沉淀生成 | H2SO4+BaCl2==BaSO4↓+2HCl Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3 |
| 盐酸及可溶性盐酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人AgNO3溶液和稀硝酸 | (1)溶液变红 (2)有白色沉淀生成,且该沉淀不溶于稀硝酸 | HCl+AgNO3=AgCl↓+HNO3 NaCl+AgNO3==AgCl↓+NaNO3 |
| 碳酸盐及碳酸氢盐 | 取少量待检验溶液于试管中 (1)加稀盐酸或稀硝酸 (2)将生成的气体通入澄清的石灰水中。 | 有气体生成,且该气体使澄清的石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 铵盐 | 将铵盐与碱混合共热 | 有刺激性气味气体生成 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
本文来自:逍遥右脑记忆 http://www.jiyifa.net/chuzhong/267178.html
相关阅读:化学教学中的德育渗透初探



