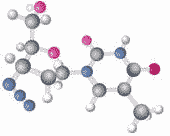
由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
概念的理解:
①分子是保持物质化学性质的“最小粒子”、不是“唯一粒子”。
②“保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的。
③分子只能保持物质的化学物质,而物质的物理性质(如:颜色、状态等)需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④“最小”不是绝对意义上的最小,而是”保持物质化学性质的最小”。如果不是在“保持物质化学性质” 这层含义上,分子还可以分成更小的粒子。
用分子的观点解释问题:
物理变化和化学变化的区别
由分子构成的物质,发生物理变化时分子本身未变,分子的运动状态、分子间的间隔发生了改变;发生化学变化时分子本身发生了变化,分子分成原子,原子重新组合变成了共他物质的分子。如:水变成水蒸气,水分子本身没有变,只是分子间的问隔变大,这是物理变化;水通直流电.水分子发生了变化,生成了氢原子和氧原子,氢.原子构成氢分子,氧原子构成氧分子,这是化学变化。
分子的表示方法:
分子可用化学式表示:如O:既可表示氧气,也可表示1个氧分子。
分子的构成:

相关初中化学知识点:验证分子特点的实验
验证分子特点的实验:
通过对分子特点的探究,可以让学生直观的感受到微观世界里分子构成物质的特点。
探究分子运动的实验:
| 实验装置 |
| ||
| 实验步骤 | 步骤1 | 步骤2 | 步骤3 |
| 在盛有约40ml 蒸馏水的烧杯中加 如5一6滴酚酞试液,搅拌均匀, 观察现象 | 取步骤I得到的溶液,置于 试管中,再向其中滴加浓 氨水,观察现象 | 将烧杯中的溶液分别倒入 A、B两个小烧杯中,另取 一个小烧杯C,加入约5ml 浓 氨水。用一个大烧杯罩住 A,C两个小烧杯,烧杯B 置于大烧杯外 | |
| 实验现象 | 无明显现象 | 溶液由无色变成红色 | 烧杯A中液体由无色变为红色,烧杯B中无变化 |
| 实验解释 | 烧杯中的浓氨水挥发出氛分子,氨分了进人烧杯A中,使溶液变成红色.而烧杯B中没有氨分子进入 | ||
探究分子间有间隙的实验:
| 实验原理 | 分子之间存在间隙且分子总是做不停地无规则运动。将水和酒精充满容量瓶,混合均匀后,若液面发生下降,则可验证分子间存在间隙。 | ||
| 实验用品 | 100ml 容量瓶 1 只、 100ml 烧杯 2 只、餐纸、保鲜膜、棉线一根、无水酒精、 纯净水、品红溶液。 | ||
| 实验装置 | 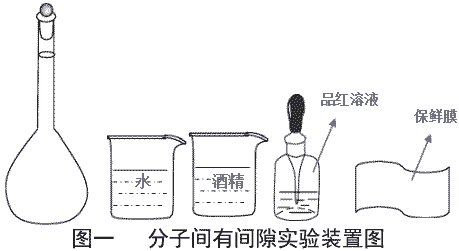 | ||
| 实验步骤 | 实验结果 | 实验结论 | |
| 实验方案一 | (1) 打开容量瓶,用小烧杯移取 70ml 已滴加了品红溶液的水于容量瓶中。 (2) 用小烧杯移取酒精于容量瓶中直至容量瓶满。 (3) 塞上容量瓶塞,有液体溢出,用餐纸擦干。倒置容量瓶几次,使液体充分混 合,观察液面下降情况。 | 液面下降 1.5cm 左右,实验现象非常明显 | 优点: (1) 酒精用量少,该实验只需耗费 30ml 左右的酒精 (2) 滴入品红溶液的水呈红色,可明显观察到在容量瓶倒置前,容量瓶中液体分 层,上层无色,下层红色。而倒置后溶液呈均匀红色。 (3) 倒置前容量瓶充满液体,排除了会有部分液体残留在容量瓶上导致的误差。 (4) 实验现象明显,混合后液面下降 1.5cm 左右 (5) 实验操作简单,实验用品少 缺点:将充满的容量瓶塞上容量瓶塞会有液体溢出,这个操作不规范。 |
| 实验方案二 | (1) 打开容量瓶,用小烧杯移取 70ml 已滴加了品红溶液的水于容量瓶中。 (2) 用小烧杯移取酒精于容量瓶中直至容量瓶满。 (3) 用保鲜膜迅速包裹容量瓶,然后将保鲜膜用细线捆紧。用手掌压住容量瓶口, 倒置容量瓶几次,使液体充分混合,观察液面下降情况。 | 液面下降 1cm 左右,实验现象非常明显。用无水硫酸铜检验容量瓶外壁, 并无液体溢出。 | 优点: (1) 酒精用量少,该实验只需耗费 30ml 左右的酒精 (2) 滴入品红溶液的水呈红色,可明显观察到在容量瓶倒置前,容量瓶中液体分 层,上层无色,下层红色。而倒置后溶液呈均匀红色。 (3) 倒置前容量瓶充满液体,排除了会有部分液体残留在容量瓶上导致的误差。 (4) 实验现象明显,混合后液面下降 1cm 左右 (5) 实验操作简单,实验用品少 (6) 方案二很好的解决了方案一的缺陷,且实验效果好。 |
相关初中化学知识点:离子结构示意图
概念:
离子结构示意图是用来表示离子核电荷数和电子排布的图示.同种元素的原子和离子其质子数相同.离子的核外电子数和质子数不同,阳离子的质子数大于核电荷数,阴离子的质子数小于核外电子数.主族元素的离子最外层一般为8个电子(最外层是K层为2个电子)。
阴阳离子的结构示意图与原子结构示意图的的区别:
1、结构示意图中,圆圈里的数字=半弧上的数字之和,它就是原子结构示意图。
2、结构示意图中,圆圈里的数字>半弧上的数字之和,它就是阳离子结构示意图。
3、结构示意图中,圆圈里的数字<半弧上的数字之和,它就是阴离子结构示意图。
相关初中化学知识点:构成物质的微粒(分子、原子、离子)
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 |  | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
本文来自:逍遥右脑记忆 http://www.jiyifa.net/chuzhong/268996.html
相关阅读:初中化学知识点:二氧化碳对环境的影响
閻楀牊娼堟竟鐗堟閿涙碍婀伴弬鍥у敶鐎瑰湱鏁辨禍鎺曚粓缂冩垹鏁ら幋鐤殰閸欐垼纭€閻氼噯绱濈拠銉︽瀮鐟欏倻鍋f禒鍛敩鐞涖劋缍旈懓鍛拱娴滄亽鈧倹婀扮粩娆庣矌閹绘劒绶垫穱鈩冧紖鐎涙ê鍋嶇粚娲?閺堝秴濮熼敍灞肩瑝閹枫儲婀侀幍鈧張澶嬫綀閿涘奔绗夐幍鎸庡閻╃ǹ鍙у▔鏇炵伐鐠愶絼鎹㈤妴鍌氼洤閸欐垹骞囬張顒傜彲閺堝绉圭€氬本濡辩悮顓濋暅閺夛拷/鏉╂繃纭舵潻婵婎潐閻ㄥ嫬鍞寸€圭櫢绱濈拠宄板絺闁線鍋栨禒鎯板殾 4509422@qq.com 娑撶偓濮ら敍灞肩缂佸繑鐓$€圭儑绱濋張顒傜彲鐏忓棛鐝涢崚璇插灩闂勩們鈧拷







