| 概念 | |
| 催化剂 | 在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。 |
| 催化作用 | 催化剂在化学反应中所起的作用 |
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
相关初中化学知识点:化合价的写法和意义
化合价的定义:
一种元素一定数目的原子跟其他元素一定数目的原子相化合的性质,叫做这种元素的化合价。化合价有正价、负价之分,如在H2O中,氢原子与氧原子的个数比为2:1,H为+1价,0为-2价;在MgCl2中,镁原子与氯原子的个数比为1:2,Mg为+2价,Cl为-1价。
化合价的意义:
化合价反映元素的原子之间相互化合时的数日,是元素的一种性质。因此,强调化合价时,一定要指明元素。
化合价的表示方法:
通常在元素符一号或原子团的正上方用+n或-n表示,“+”“-”在前,数值在后。“1”不能省略。例如
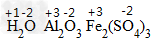 .
.化合价的一般规律:
(1)化合价有正价和负价;
(2)金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价,如MgCl2中Mg为+2价,Cl为-1价;非金属元素和氧元素形成化合物时,非金属元素通常显正价,氧元素通常显-2价,如SO2中S为+4价,O为-2价;
(3)一些元素在不同物质中可显不同的化合价,如KMnO4、K2MnO4中锰元素的化合价分别为+7,+6价;
(4)化合物中,各元素正、负化合价代数和为0;
(5)因为化合价是元素的原子在形成化合物时才表现出来的一种性质,所以单质中元素的化合价为0;
(6)原子团不能独立存在,只是化合物的一个组成部分,所以原子团的化合价由各元素的正、负化合价的代数和算出,原子团的化合价一定不为0。
化合价与最外层电子数的关系:
(1)金属元素的化合价数值一般等于它的最外层电子数。
(2)非金属元素的最高正价数值等于它的最外层电子数(O、F除外),最低负价数值等于8减去最外层电子数。
化合价符号与离子符号的比较
| 元素化合价的符号 | 离子符号 | |
| 概念不同 | 表示元素原子所显化合价的数值和正负的符号 | 表示带电原子(或原子团)所带电荷的电性核电荷量的符号 |
| 位置不同 | 化合价写在元素符号或原子团的正上方 | 所带电荷写在元素符合(或原子团)的右上角。 |
| 前后不同 | 正负号在前,数字在后 | 数字在前,正负号在后 |
| 省略不同 | 化合价为+1或-1价时,数字1不能省略 | 带一个单位正电荷或负电荷时,“1”不能省略不写 |
一些常见元素和根的化合价:
| 元素和根的名称 | 元素和根的符号 | 常见的化合价 | 元素和根的名称 | 元素和根的符号 | 常见的化合价 |
| 钾 | K | +1 | 氯 | Cl | -1、+1、+5、+7 |
| 钠 | Na | +1 | 溴 | Br | -1 |
| 银 | Ag | +1 | 氧 | O | -2 |
| 钙 | Ca | +2 | 硫 | S | -2、+4、+6 |
| 镁 | Mg | +2 | 碳 | C | +2、+4 |
| 钡 | Ba | +2 | 硅 | Si | +4 |
| 铜 | Cu | +1、+2 | 氮 | N | -3、+2、+3、+4、+5 |
| 铁 | Fe | +2、+3 | 磷 | P | -3、+3、+5 |
| 铝 | Al | +3 | 氢氧根 | OH- | -1 |
| 锰 | Mn | +2、+4、+6、+7 | 硝酸根 | NO3- | -1 |
| 锌 | Zn | +2 | 硫酸根 | SO42- | -2 |
| 氢 | H | +1 | 碳酸根 | CO32- | -2 |
| 氟 | F | -1 | 铵根 | NH4+ | +1 |
记忆口诀:
常见元素的化合价口诀
(1)一价钾、钠、银、氢、氟,二价钙、镁、钡和锌,铝价正三氧负二,以上价态要记真。铜一二来铁二三,碳硅二四要记全,硫显负二正四六,负三正五氮和磷,氯价最常显负一,还有正价一五七,锰显正价二四六,最高价数也是七。
(2)常见原子团的化合价口诀
一价铵根氢氧根,另有硝酸氯酸根。二价硫酸碳酸根,勿忘一个锰酸根。三价只有磷酸根。除了铵根皆为负,常写常用能记住。
相关初中化学知识点:元素的推断
元素推断题:
元素推断题是中学化学练习中的一种重要题型,该类题型以原子结构、周期表等为题干,集基本概念、基础理论及元素化合物知识于一身,具有综合性比较强的特点。
元素推断的规律:
一、原子结构与元素在周期表中的位置关系的规律
1.周期数=核外电子层数
2.族序数=主族元素的最外层电子数
3.质子数=原子序数=原子的核外电子数
4.主族元素的最高正价=族序数
5.最低负价=最高正价-8
二、根据族序数与周期序数的比值判断金属性与非金属性的强弱(族序数—m;周期—n)
1.
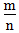 <1时,为金属,
<1时,为金属,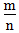 越小,金属性越强
越小,金属性越强2.
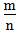 >1时,为非金属,
>1时,为非金属,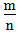 越大,非金属性越强
越大,非金属性越强 3.
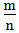 =1时,为两性元素
=1时,为两性元素 三、根据元素的性质,存在及用途的特殊性来推断元素
1.形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素,或气态氢化物中氢的质量分数最大的元素:C
2.空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N
3.地壳中含量最多的元素,或气态氢化物沸点最高的元素,或氢化物在通常情况下呈液态的元素:O
4.地壳中含量最多的金属元素:Al
5.最活泼的非金属元素,或无正价的元素,或无含氧酸的非金属元素,或无氧酸可腐蚀玻璃的元素,或气态氢化物最稳定的元素,或阴离子的还原性最弱的元素:F
6.最活泼的金属元素,或最高正价氧化物对应的水化物碱性最强的元素,或阳离子氧化性最弱的元素:Cs
7.最容易着火的非金属元素的单质,其元素是:P
8.焰色反应:黄色:Na;紫色:K
9.最轻的单质的元素:H;最轻的金属元素:Li
10.常温下单质呈液态的非金属元素:Br;金属元素:Hg
11.两性元素:Al,Be,Zn
12.元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素:N
13.元素的气态氢化物能和它的氧化物在常温下反应,生成改元素的单质元素:S 14.常见的能形成同素异形体的元素:C,P,O,S
四、周期表中特殊位置的元素
1.族序数=周期数的元素:H,Be,Al
2.族序数=周期数2倍的元素:C
3.族序数=周期数3倍的元素:O
4.周期数是族序数2倍的元素:Li
5.周期数是族序数3倍的饿元素:Na
6.最高正价与最低负价代数和为零的短周期元素:C,Si
7.最高正价是最低负价绝对值3倍的短周期元素:S
8.除H外,原子半径最小的元素:F
9.短周期中离子半径最大的元素:S
10.最高正化合价不等于族序数的元素:F,O 五、元素周期表中的规律
五、元素周期表中的规律
1.各周期的元素种数(n表示周期序数)
(1)n为奇数:
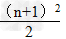
(2)n为偶数:
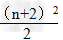
2.元素位置的确定
(1)根据原子结构示意图
①电子层数=周期序数
②最外层电子数=主族序数
(2)根据相近的稀有气体元素的原子序数:未知元素的原子序数-与之最接近的稀有气体元素的原子序数
①得数为正:该稀有气体的下一周期
②得数为负:与该稀有气体在同一周期
3.IIA族与IIIA族原子序数差值规律
(1)不跨过渡+1
(2)跨过过渡+11
(3)跨过锕镧+25
4.同主族元素的原子序数差值规律:左上右下规律
(1)IA族和IIA族(左):b=a+m
(2)IIIA族~VIIA族(右):b=a+n
(a:上一周期元素的原子序数;b:下一周期元素的原子序数;m:上一周期的元素种数;n:下一周期的元素种数)
5.阴上阳下规律:
(1)原子序数相同的阴阳离子,阴离子在上一周期,阳离子在下一周期
(2)离子半径:阴离子>阳离子
(3)原子半径:阴离子对应原子<阳离子对应原子
相关初中化学知识点:酸碱指示剂
酸碱指示剂:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
| 酸性溶液 | 碱性溶液 | 中性溶液 | |
| 石蕊试液 | 红 | 蓝 | 紫 |
| 酚酞试液 | 无 | 红 | 无 |
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
| 代用指示剂的颜色 | |||
| 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 苏木 | 黄色 | 红棕色 | 玫瑰红色 |
| 紫萝卜皮 | 红色 | 紫色 | 黄绿色 |
| 月季花 | 浅红色 | 红色 | 黄色 |
| 美人蕉 | 淡红色 | 红色 | 绿色 |
本文来自:逍遥右脑记忆 http://www.jiyifa.net/chuzhong/279474.html
相关阅读:初中化学学习技巧 结合生活
闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ょ紓宥咃躬瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁绘劦鍓欓崝銈囩磽瀹ュ拑韬€殿喖顭烽幃銏ゅ礂鐏忔牗瀚介梺璇查叄濞佳勭珶婵犲伣锝夘敊閸撗咃紲闂佺粯鍔﹂崜娆撳礉閵堝洨纾界€广儱鎷戦煬顒傗偓娈垮枛椤兘骞冮姀銈呯閻忓繑鐗楃€氫粙姊虹拠鏌ュ弰婵炰匠鍕彾濠电姴浼i敐澶樻晩闁告挆鍜冪床闂備胶绮崝锕傚礈濞嗘挸绀夐柕鍫濇川绾剧晫鈧箍鍎遍幏鎴︾叕椤掑倵鍋撳▓鍨灈妞ゎ厾鍏樺顐﹀箛椤撶偟绐炴繝鐢靛Т鐎氱兘宕ラ崨瀛樷拻濞达絿鎳撻婊呯磼鐠囨彃鈧潡鐛径濞炬闁靛繒濮烽鎺旂磽閸屾瑧鍔嶅畝锝呮健瀹曘垽鏌嗗鍡忔嫼闂傚倸鐗婄粙鎾存櫠閺囥垺鐓欓柛鎰叀閸欏嫭銇勯姀鈩冾棃妞ゃ垺锕㈡慨鈧柨娑樺楠炴劙姊虹拠鑼闁稿绋掗弲鍫曟寠婢规繆娅i埀顒佺⊕閿曗晛鈻撴禒瀣厽闁归偊鍨辫ぐ褔鏌ら弶鎸庡仴闁哄瞼鍠庨悾鐑藉炊瑜夐弸鍛渻閵堝啫鐏い銊ユ椤曘儵宕熼娑樹壕闁挎繂妫欑亸鎵磼椤旇姤灏い顐㈢箳缁辨帒螣鐠囧樊鈧捇鏌i悢鍝ユ噧閻庢凹鍓氱粋鎺楀煛閸涱喒鎷洪梺鍛婄☉閿曘儵鎮¢妷褏纾煎璺猴功閸╋絾顨ラ悙鏉戠伌濠殿喒鍋撻梺闈涚墕閹虫劙藝閵娿儺娓婚柕鍫濇閻撱儲淇婇幓鎺斿ⅵ闁轰礁鍟村畷鎺戔槈濮橆剙绠為梻鍌欑閹碱偄煤閵忋倕绀夌€光偓閸曨剙鈧爼鏌eΟ鑲╁笡闁绘挻娲熼弻鐔兼嚋椤掆偓婵$厧霉濠婂嫬鍔ら柍瑙勫灴閺佸秹宕熼鈩冩線闂備胶枪閿曘儵鎮ч悩鑼殾婵犻潧顑嗛弲婵嬫煃瑜滈崜鐔煎灳閿曞倸閿ゆ俊銈傚亾闁绘帒鐏氶妵鍕箳閹存繍浠鹃梺缁樻尰缁嬫垿鈥﹂崸妤佸殝鐎电増顨忔禍婊堫敋閿濆鏁婇柤鎭掑劚瀵寧绻濋悽闈浶㈤柛鐕佸灦婵¢潧鈹戠€n偆鍘搁柣蹇曞仩婵倝宕甸崶顒佺厵妞ゆ梻鏅幊鍥煙瀹曞洤啸闁圭懓瀚粭鐔碱敍濞嗘垹锛炴繝鐢靛Х閺佸憡鎱ㄩ銏犵闁告劦浜欏▽顏堟煠閹帒鍔ょ憸鏉块叄濮婄粯鎷呴崨濠冨創闂佸搫鐗滈崜鐔煎箚閸曨垼鏁嶉柣鎰皺閻f椽姊洪棃娑氱疄闁稿﹥娲栭蹇撯攽閸″繑鏂€闂佺粯蓱瑜板啴顢旈锔界厓閻犲洩灏欑粻缁樻叏婵犲嫮甯涢柟宄版噺椤︾増鎯斿┑濠庢船缂傚倸鍊烽悞锕併亹閸愩劇缂氶柍銉ョ-閺嗭附淇婇妶鍌氫壕闁句紮缍侀幃瑙勬媴閸濄儻绱炵紓浣哄У閼归箖鍩為幋锔绘晩闁伙絽鐬奸悾鐢告⒑濞茶骞栭柣妤€妫楀畵鍕⒑缂佹ê鐏卞┑顔哄€濋崺娑㈠箣閻樼數锛滈柣搴秵閸嬫帡宕曢妷鈺傜厱閹兼番鍨规慨宥夋煛瀹€鈧崰鏍х暦閵婏妇绡€闁告劑鍔夐崑鎾诲箛閻楀牏鍘遍梺宕囨嚀閻忔繈宕濆⿰鍛亾閸偅绶查悗姘煎幘閹广垹鈽夐姀鈥斥偓閿嬨亜閹烘垵鈧敻宕戦幘璇蹭紶闁告洖鐏氱€靛矂姊洪棃娑氬婵☆偅鐟ч埀顒€鐏氶悷鈺呭蓟濞戞矮娌柛鎾楀懐鍘愰梻浣规偠閸娿倝宕滃☉姘潟闁规崘顕х壕鍏肩箾閸℃ê鐒炬俊宸櫍濮婅櫣绮欓崠鈥充紣闂佺濮ょ划搴ㄥ礆閹烘绫嶉柛顐ゅ櫏濡啫鈹戦悙鏉戠仸闁告梹顨堝Σ鎰鐎涙﹩妫呭銈嗗姂閸ㄧ儤寰勯崟顓犵<閻庯綆鍋勯悘锕傛煕鎼搭喖浜伴柡宀嬬秮閹垽宕妷褏鍘愮紓鍌欒兌缁垶鏁冮姀銈囧祦闁糕剝岣块悷褰掓煃瑜滈崜娆撴偩闁垮闄勭紒瀣嚦閵娾晜鐓ラ柡鍐ㄦ祩濞兼劙鎮楀顒€鎮戠紒缁樼箓閳绘捇宕归鐣屼壕闂備胶顢婂▍鏇㈠箰閸濄儱寮查梻渚€娼ч悧鍡浰囨导鏉戠9闁割偅娲橀悡鏇熺箾閸℃绂嬫俊鑼舵缁辨帡鎮╅崘鎻掑Б闂傚洤顦甸弻銊モ攽閸℃ê娅i梺鍝勬娴滃爼寮诲☉銏″亜閻犲搫鎼粊顔嘉旈悩闈涗沪妞ゃ劌锕ユ穱濠囨倻閽樺鍘搁梺绋挎湰椤ㄥ棛鈧矮绮欏缁樻媴閸涢潧缍婂鐢割敆閸曨剙浠梺闈浥堥弲娑氱矆閸屾壕鍋撻崗澶婁壕闂佸憡娲﹂崑鍕吹閹存繍娓婚柕鍫濇噽缁犱即鏌eΔ鈧敃顏堝箖閿熺姴唯闁冲搫鍊婚崢鎼佹⒑閹肩偛鍔撮柣鎾茬窔椤㈡棃宕煎┑鍫濆Е婵$偑鍊栫敮濠囨嚄閸撲胶涓嶉柣鎰劋閻撳繘鏌涢埄鍐╃妞わ讣闄勯妵鍕敃閿濆洨鐣洪梺鎸庣⊕閸旀洟鍩為幋锕€鐐婇柕濠忓瑜板酣姊婚崒姘偓鐑芥嚄閸撲礁鍨濇い鏍ㄧ箖閹冲矂姊绘担鍛婂暈闁圭ǹ顭烽幊婵嬪箚瑜忛獮鎾绘煕瑜庨〃鍡涘磻閸曨垱鐓曢煫鍥ㄦ尵濮g偤鏌熼柨瀣仢婵﹥妞藉Λ鍐煛娴g儤袙闂備礁鎲¢敋闁告艾顑囩划瀣吋閸℃劕浜濋梺鍛婂姀閺呮繈宕㈤柆宥嗏拺闁荤喐婢橀埛鏃€銇勯妷锕€濮堢紒鏃傚枎铻i柧蹇氼潐濞堟洟姊洪幐搴g畵闁瑰啿绻樺畷鎴﹀Ψ閳哄倻鍘遍梺鍐叉惈椤戝洨寮ч埀顒勬倵鐟欏嫭纾搁柛鏃€鍨块妴浣糕枎閹惧磭鐣鹃悷婊冪Ф缁粯绻濆顓涙嫽闂佺ǹ鏈悷褔藝閿曞倹鐓欓悹鍥囧懐锛熺紓鍌氬€归幑鍥х暦缁嬭鏃堝焵椤掑倸顥氶柛褎顨嗛悡娑㈡倶閻愰鍤欓柛鏃€纰嶉幈銊ф喆閸曨厼寮ㄩ梺鍝勮嫰缁夌懓鐣烽锕€绀嬫い鎺嗗亾婵炲懌鍊濆铏圭磼濡闉嶅┑鐐插级钃辩紒宀冮哺缁绘繈宕堕懜鍨珫婵犳鍠楅敃鈺呭储娴犲纾块柟鍓х帛閳锋垿鏌涜箛姘汗闁硅棄鍟妵鍕敃閵忊晜鈻堟繝纰夌磿閺佽鐣烽悢纰辨晬闁挎繂妫欏▍鍡涙⒒娴e憡鍟炴繛璇х畵瀹曟垿宕ㄩ娑欑亖缂傚倷鐒﹀玻璺ㄥ姬閳ь剛绱掗崜褍顣奸懣銈夋煕鐎n偅灏柣锝囧厴瀹曟儼顦撮柛妯圭矙閺岋絾鎯旈妶搴㈢秷濠电偛寮堕悧鏇㈡偩閻戠瓔鏁嗛柛鎰典簷缁ㄧ兘姊婚崒娆戠獢闁逞屽墰閸嬫盯鎳熼娑欐珷闁圭虎鍠楅悡銉︾節闂堟稓澧曞ù鐘轰含閳ь剝顫夊ú鏍偉婵傛悶鈧礁螖娴g懓顎撻梺鍛婄懃椤︻垶顢旈崷顓犵=闁稿本鑹鹃埀顒勵棑缁牊绗熼埀顒勩€侀弽顓炲窛妞ゆ牗鐟ч崜銊╂⒑閸涘﹦鈯曟繛鍏肩懅缁辨帡鍩¢崘顏嗭紳婵炶揪缍€閻ゎ喚绱撳杈╃<闁绘ǹ宕甸悾娲煛鐏炶鈧宕版繝鍥х闁绘劕妯婂ḿ濠氭⒒娴e憡鎯堟い鎴濇噽閳ь剚绋堥弲鐘充繆閻㈢ǹ绀嬫い鏍ㄨ壘瀹撳棗顪冮妶鍛婵☆偅绋栭埅闈涒攽鎺抽崐妤佹叏閻戣棄纾婚柣鎰劋閸嬪淇婇妶鍛櫣缂佺媭鍨堕弻娑樷槈濞嗘劗绋囨繛纾嬪亹婵炩偓闁哄本娲樼粩鐔碱敍濮橆剦浼€缂備礁顦介崳锝咁潖婵犳艾纾兼慨姗嗗厴閸嬫挻顦版惔锝囩劶婵炶揪绲藉﹢閬嶆偟鐠鸿 鏀介柣妯哄级閹兼劗鐥幆褜鐓奸柡灞剧洴閸╁嫰宕橀浣诡潔缂傚倷鐒﹂崝鏍€冩繝鍥ц摕闁绘梻鍘х粻鏌ユ煙娴煎瓨娑ф繛鍫弮濮婅櫣绮欓懗顖f蕉闂佸憡姊归崹鍨嚕婵犳碍鏅濋柍褜鍓濋悘鎺撶箾閹炬潙鍤柛銊ュ船閻☆參姊婚崒娆愮グ闁靛棌鍋撻梺绋款儐閹告悂婀侀梺缁樏Ο濠囧磿閹扮増鐓熼柟鎹愭硾閺嬫垵菐閸パ嶈含妞ゃ垺绋戦埞鎴﹀幢閺囩喓娼栭梻浣圭湽閸╁嫰宕规潏鈺冪煓闁圭儤姊瑰畷鍙夌箾閹存瑥鐏╃紒鐘靛Х閳ь剛鎳撶€氼厼顭垮鈧、鏃囶槾缂佽鲸甯為幏鐘诲矗婢舵ɑ锛侀梻渚€娼уú銈団偓姘嵆閻涱噣宕堕鈧粈鍫澝归敐鍥ㄥ殌濞寸姾顫夌换婵嬫偨闂堟稐娌悷婊勬緲閸熸挳銆佸棰濇晣闁靛繒濮烽崝锕€顪冮妶鍡楃瑨闁哥姵鑹惧玻鍧楀箛椤撶姷顔曢梺鍛婄懃椤ャ垽顢旈崼姘e亾閺冨牆绀冮柍鍝勫枤濞村嫰鏌f惔顖滅У濞存粍绻堥幃妤咁敆閸曨兘鎷洪悷婊呭鐢帗绂嶆导瀛樼厱婵☆垰鐏濇禍瑙勭箾閸℃劕鐏查柟顔界懇閹粌螣鐞涒€充壕闁汇垹鎲¢悡銉︾節闂堟稒顥㈡い搴㈩殔椤儻顧侀柛鐘愁殜閵嗗啴濡烽埡鍌氣偓鐑芥煛婢跺鐏ユい顐e浮濮婃椽宕崟顓犲姽缂備焦鐓$粻鏍嵁閸℃稑绫嶉柛顐g箘娴煎姊洪崨濠傚閻忓浚浜炲▎銏ゆ偄閸忓皷鎷绘繛杈剧到閹虫瑨銇愰幒婵囨櫈闂佺硶鍓濈粙鎴犵不閺屻儲鐓曢柕澶樺枛婢ь喚绱掗悩宕囧濞e洤锕俊鍫曞川椤斿吋顏¢梻浣告惈閹冲繘鎮¢敓鐘靛祦闁哄稁鍋勯崹婵嬫煕韫囨搩妲稿ù婊堢畺閺岀喐锛愭担鍝勫婵炲瓨鍤庨崐婵嗩潖婵犳艾纾兼繛鍡樺笒閸橈紕绱掔紒銏犲箹闁绘牜鍘ч锝夊箵閹哄棙顫嶉梺闈涚箚閳ь剙鍟挎竟鎺楁⒒娴e懙褰掓儔婵傜ǹ纾绘繛鎴欏灪鐎氬懘鏌i弮鍌氬妺闁哥姵鍔欓悡顐﹀炊閵婏妇顦ㄥ銈庡亝濞茬喖寮婚悢鍏煎€绘俊顖滃劋椤旀洟姊虹紒妯荤叆闁告艾顑夊畷鎴﹀磼閻愯尙顔愰柣搴㈢⊕閵嗙偤骞嬮悩顐壕婵﹩鍘鹃崣鈧┑顔硷工椤嘲鐣烽幒鎴旀瀻闁规惌鍘借ⅵ闂傚倷绀佸﹢閬嶅煕閸儱纾诲┑鐘叉搐缁犵娀鏌i弮鍌楁嫛闁轰礁绉电换婵囩節閸屾稑娅ч梺缁樻尭椤戝顫忛搹鍦<婵☆垵娅f导宀勬⒑閸︻厾鎽傚ù婊庝簼娣囧﹪骞栨担瑙勬珕闂佸憡鎸嗛崟顐g杽闂傚倸鍊风欢姘跺焵椤掑倸浠滈柤娲诲灡閺呭墎鈧數纭堕崑鎾斥枔閸喗鐏曞銈嗘肠閸パ呭弨婵犮垼鍩栭崝鏇綖閸涘瓨鐓熸俊顖涙た閸熷繘鏌涢悢濂夊剶婵﹥妞介幊锟犲Χ閸涘拋鍓氱换娑㈠椽閸愵亞袦閻庤娲樺ú鐔镐繆閼搁潧绶為悗锝庝簴閸嬫捇宕奸弴鐔哄幈濡炪倖鍔х徊楣冨磿閺囥垺鐓涢柛鎰╁妿婢ф盯鏌涚€n偄濮嶆慨濠傤煼瀹曞ジ鎮㈢悰鈩冿級缂傚倷绶¢崰鏍偉閻撳寒娼栨繛宸簻娴肩娀鏌曟径鍫濆姕闁诲海鍋撶换婵嬫偨闂堟稐绮堕梺鎸庢磸閸斿矁鐏嬮梺缁樻煥閸氬宕愰悽鍛婂仭婵炲棗绻愰顏嗙磼閳ь剟鍩€椤掆偓閳规垿鎮欓懠顒佸嬀闂佸憡鏌ㄧ€涒晝绮╅悢鐓庡嵆闁靛繆鈧櫕鐣伴梻浣稿暱閹碱偊宕导瀛樻櫖婵犻潧娲ㄧ粻楣冨级閸繂鈷旂紒澶樺墴閺岋綁濡舵惔鈩冪亾缂備浇椴搁幐鎼侊綖濠靛洦缍囬柍鍝勫枦缁辨煡姊绘担铏瑰笡闁挎洏鍨瑰玻鑳槼缂佸倹甯熼ˇ褰掓煛鐏炵晫啸妞ぱ傜窔閺屾盯骞樼€靛摜鐤勯梺鎸庣箘閸嬬偛顕ラ崟顒傜闁圭儤鍨堕幆鍫ユ煃鐟欏嫬鐏╅柍褜鍓ㄧ紞鍡樼濠靛柈锝夘敆閸曨兘鎷洪梺鍛婄箓鐎氼噣鍩㈡径鎰厱婵☆垳绮ˉ鍫⑩偓瑙勬礀閻栧ジ銆佸Δ浣瑰闂傗偓閹邦喚绉块梻鍌氬€风粈浣圭珶婵犲洤纾婚柛鈩冪☉缁愭骞栧ǎ顒€濡肩紒鈧径鎰厱婵炴垶岣块幗鐘绘煃闁垮鐏撮柡宀€鍠撶划娆撳箰鎼淬垹闂紓鍌欒兌婵敻骞戦崶顒€钃熸繛鎴炵懅缁♀偓闂佺ǹ鏈划搴㈩殭闂傚倷娴囧銊х矆娴h櫣鐭撻柣鐔稿閺嗭箑鈹戦崒婧撶懓鏁梻浣瑰濡線锝炴径灞稿亾濮橆偆鐭欐慨濠勭帛閹峰懘宕ㄩ棃娑氱Ш鐎殿喚鏁婚、妤呭礋椤掆偓濞堢偞淇婇妶蹇曞埌闁哥噥鍋婇幃鐐哄垂椤愮姳绨婚梺鍦劋閸ㄧ敻顢旂€涙ü绻嗘い鎰剁到閻忊晝绱掓潏銊ユ诞妞ゃ垺鐟╅幊鏍煛娓氬洦婢戠紓鍌氬€烽悞锕傘€冮崼銉ョ獥闁哄稁鍘奸弰銉╂煃瑜滈崜姘跺Φ閸曨垰绠抽柟瀛樼箥娴尖偓闁诲氦顫夐幐椋庢濮樿泛钃熼柍銉﹀墯閸氬骞栫划鍏夊亾閸愬樊鍔€闂傚倷娴囧銊х矆娓氣偓瀹曨垶骞橀鑹版憰闂佸搫娲㈤崹褰掓煁閸ャ劎绡€闂傚牊绋掗幖鎰磼閹邦厾娲存慨濠呮缁辨帒螣鐠囨煡鐎洪梻浣筋潐閻℃洖鐣烽悽绋跨闁靛繒濮Σ鍫ユ煏韫囨洖啸妞ゆ梹甯″娲传閸曞灚效闂佹悶鍔岀紞濠傜暦濠靛洤顕遍悗娑櫱氶幏铏圭磽娴e壊鍎愭い鎴炵懇瀹曟洟骞囬悧鍫㈠幍闂佸綊妫块懗鍫曟偩濞差亝鐓曢柍瑙勫劤娴滅偓淇婇悙顏勨偓鏍暜閹烘绐楁慨姗嗗厳缂傛岸鏌熼柇锕€骞樼紒鐘荤畺閺岀喓绱掑Ο铏诡儌缂備胶濮惧畷鐢稿焵椤掑喚娼愭繛鍙夌墱缁辩偞绻濋崶褏顔愰悷婊呭鐢帡骞戦懜鐐逛簻闁规崘娉涘暩闂佸憡鏌ㄧ紞濠傤潖缂佹ɑ濯撮柛娑橈龚绾偓闂備胶枪缁ㄦ椽宕愬┑鍡╁殨濠电姵纰嶉弲鎼佹煟濡灝鐨洪柨娑欑洴濮婃椽鎮烽弶搴撴寖缂備緡鍣崹璺侯嚕閺屻儱钃熼柕澶堝劤椤旀劗绱撴笟鍥ф灈闁告ɑ绮撳畷鎴﹀箻缂佹ê娈ゅ銈嗗笒閸婂綊寮查妸銉㈡斀闁绘ê鐏氶弳鈺呮煕鐎n偆娲撮柟顔芥そ婵℃瓕顦查柛銊︾箘閳ь剙绠嶉崕閬嵥囬銏犵劦妞ゆ巻鍋撻柛鐕佸灣閹广垹鈹戠€n亞锛滈梺闈涚墕濡稓绮欐担鍦瘈闁汇垽娼ф禒婊勪繆椤栨熬鏀荤紒鍌氱Т閳规垹鈧絽楠搁ˇ闈涚暦婵傚憡鍋勯柧蹇氼嚃閸熷酣姊绘担渚敯闁规椿浜炵槐鐐寸瑹閳ь剙鐣烽锔藉€绘俊顖炴櫜缁ㄥ鏌熼懖鈺勊夐柛鎾寸箞钘熼柣鎰暩绾捐偐绱撴担璐細缂佺姵锕㈤弻娑㈡偐鐠囇冧紣闁句紮绲块埀顒傛嚀鐎氫即銆傞敂鐣岀彾闁哄洢鍨洪埛鎴︽煙椤栧棗瀚々浼存⒑缁嬫鍎忛悗姘煎枤閸掓帡鏁愰崨顏咁潔濠殿喗枪娴滎剟鏁嶅┑鍥╃闁瑰墽顥愭竟妯荤箾鐏炲倸鈧繂顕i幖浣肝ч柛銉㈡櫇閿涙粌顪冮妶鍡樼闁瑰啿閰i幃姗€鏁冮埀顒勫煘閹达箑鐏崇€规洖娲ら悡鐔兼⒑鏉炴壆鍔嶉柛鏃€鐗曢銉╁礋椤掑倻鐦堥梺鍛婃礀閻忔俺鈪烽梻鍌氬€搁崐椋庣矆娓氣偓瀹曨垶宕稿Δ鈧粻瑙勩亜閹板墎鐣遍柣銈庡枟閵囧嫰骞囩捄渚喘閻庤鎸烽懗鍫曞焵椤掆偓缁犲秹宕曢柆宓ュ洦瀵奸弶鎴犲幈闂佺鎻梽鍕磻閿濆鐓曢柕澶嬪灥閸熺増顨ラ崶顒佲拺闁革富鍘介鐔虹磽瀹ュ嫮绐旂€殿喖顭烽崺鍕礃閳轰緡鈧捇姊洪崨濠勨槈闁挎洏鍊濆鎶藉醇閵夛腹鎷洪柣鐘叉穿鐏忔瑧绮婚弻銉︾厽闁绘洖鍊搁々顒勬煙楠炲灝鐏╅柍钘夘槸椤繈鏁愰崨顒€顥氶梻浣圭湽閸ㄨ鈻嶉妷銊d汗闁硅櫣鍋熺粙蹇涙⒑閸︻厼鍔嬫い銊ユ閹繝寮撮姀锛勫帾婵犮垼鍩栫粙鎾诲礆閺夊簱鏀介柍銉ㄦ珪閸嬨儵鏌$仦鍓р槈閾伙綁鏌涜箛鎾虫倯婵絽鐗嗛埞鎴︻敊绾攱鏁惧┑锛勫仩濡嫰鎮鹃悜钘壩╅柨鏂垮⒔閻﹀牓姊虹粙鎸庢拱闁告垹鎳撳玻鍧楀箻缂佹ḿ鍘介柟鍏肩暘閸╁嫰宕箛娑欑厱闁绘ê纾晶鐢告煙椤斿搫鍔﹂柟顔瑰墲閹棃鏁愰崱姗嗗晭闂傚倷绀侀幉锟犲礉濮椻偓钘熼柛鈩冾樅濞差亶鏁傜€广儱妫欏▍鍡涙⒒娴e憡鍟炲〒姘殜瀹曞綊骞嶉鑺ユ婵°倧绲介崯顖炲煕閹烘嚚褰掓晲閸偅缍堥梺绋款儑婵炩偓闁哄本绋掗幆鏃堝閵忋垻鍘滈柣搴ゎ潐濞叉﹢鏁冮姀鐘垫殾闁挎繂顦敮閻熸粌绻橀弫宥夋倷閻戞ǚ鎷婚梺绋挎湰閼归箖鍩€椤掆偓閸㈡煡婀侀梺鎼炲劀鐏炲墽顩梻渚€娼ц墝闁哄懏绮撳畷鎰板锤濡や胶鍙嗛梺鍝勬川閸嬫盯鍩€椤掆偓閹芥粎鍒掗崼鐔风窞閻庯綆鍓涢鏇㈡⒑缁洖澧叉い銊ョ墢缁骞庨懞銉у幐闂佺硶妲呴崢楣冩偩閻㈠憡鐓涢悘鐐靛亾缁€鍐磼缂佹ḿ娲撮柟顔界懇椤㈡鎷呴崫鍕◥闂傚倸鍊峰ù鍥ь浖閵娧呯焼濞达綀顕氬ú顏嶆晣闁靛繒濮鹃幗鏇㈡⒑閹稿海绠撻柟鍙夛耿閹垽鎮℃惔锛勨偓顓烆渻閵堝棙鐓ラ柛姘儔瀹曟洟顢旈崼鐔哄幗闁瑰吋鐣崐銈呩缚閹邦厾绠鹃柛娆忣槳缂傛岸鏌涢幒鎾崇瑲闁诡垱妫冮弫鎰板幢閳哄倻绋愰梻鍌欐祰椤鐣峰鈧、姘愁槾濠㈣娲熷畷妤呭礂閻撳骸浼庢繝娈垮枟椤ㄥ懎螞濡ゅ懎鍌ㄩ柟缁㈠枟閻撴洟鎮楅敐搴′簼鐎规洖鐭傞弻鐔碱敊閻e瞼鐓夐梺鐟扮-閸嬨倖淇婇悜钘壩ㄩ柨鏃傚亾濞堟悂姊婚崒姘偓椋庣矆娓氣偓楠炲鏁撻悩鑼唶婵$偛顑呭ù鐑芥儗閸℃ぜ鈧帒顫濋敐鍛闁诲氦顫夊ú婊堝箠閹捐鐓橀柟杈剧畱閻愬﹪鏌曟径鍫濃偓妤呮儎鎼淬劍鈷掑ù锝呮啞閹牏绱掓径瀣弨鐎规洘绻冮幆鏃堝Ω閿曗偓閸撳綊鏌f惔顖滅У闁稿繑锕㈠畷鎴﹀箻閼搁潧鏋傞梺鍛婃处閸撴盯藝閵娾晜鈷戠紓浣股戦幆鍫㈢磼缂佹ḿ绠撴い鏇悼閹风姴霉鐎n偒娼旈梻渚€娼х换鍡涘疾濠婂牆鐤炬繝闈涱儐閳锋垹绱撴担骞库偓鐐哄箣閿濆啩姹楅梺鍛婂姀閺呮粓宕h箛娑樼婵烇綆鍓欐俊浠嬫煃闁垮鐏撮柡灞剧☉閳规垿宕卞Δ濠佹偅婵$偑鍊曠换鍫ュ磿閻㈢ǹ钃熸繛鎴炵懄閸庣喖鏌ㄥ┑鍡橆棡婵絽鐗撻幃妤€鈻撻崹顔界仌濡炪倖娉﹂崶鑸垫櫍婵犻潧鍊绘灙闂佸崬娲﹂妵鍕箛閸撲胶校闂侀€炲苯澧繛宸幖椤繒绱掑Ο璇差€撻梺鍛婄☉閿曘倝寮抽崼銉︹拺閻熸瑥瀚幗鍐┿亜閺囧棗娲﹂崑鈺傜節闂堟侗鍎忕€瑰憡绻傞埞鎴︽偐鏉堫偄鍘$紓浣哄У瀹€绋款潖閸濆嫅褔宕惰娴煎嫰鏌$€e吀绨界紒杈ㄥ浮閸┾偓妞ゆ帒鍊甸崑鎾绘晲鎼粹€茬按婵炲瓨绮嶇划鎾诲蓟閳ユ剚鍚嬮柛鎰╁妼椤姊哄Ч鍥у闁搞劌鐖兼俊鐢稿礋椤栨碍顥濋梺鍛婄叚閵堝懏鍎撻梻鍌欐祰椤曟牠宕板Δ鍛偓鍐╃節閸ャ劌浠掑銈嗘磵閸嬫挾鈧娲栫紞濠囥€佸▎鎾村亗閹兼惌鍠楃紞鎾寸節閻㈤潧啸闁轰焦鎮傚畷鎴︽倷閸愬瞼绱板┑鐐叉閹稿摜澹曢崷顓犵<閻庯綆浜炴禒銏㈢磼娓氬洤浜濆ǎ鍥э躬閹瑩顢旈崟銊ヤ壕闁哄诞灞剧稁婵犵數濮甸懝楣冩偂閺囥垺鐓曟い鎰剁悼缂傛岸鏌嶈閸撴氨鏁Δ鍐╁床婵犻潧妫ḿ鈺傘亜閹捐泛孝閻㈩垶绠栧缁樻媴缁嬫妫岄梺绋款儏閹虫劙骞戦姀銈呯妞ゆ柣鍨归ˇ鐢稿箖濞嗘挻鍋ㄩ柣銏㈩暜缁辨煡姊绘笟鈧埀顒傚仜閼活垱鏅舵导瀛樼厓鐟滄粓宕滈妸褏绀婇柛鈩冪☉閻掑灚銇勯幋鐐插姢闁诲浚鍣i弻鐔兼惞椤愶絽纾抽梺闈涚墱娴滄繄鈧潧銈稿鍫曞箣閻欌偓濡茬増淇婇悙顏勨偓鏇犳崲閹邦喒鍋撳鐓庢珝鐎规洏鍨虹粋鎺斺偓锝庡亞閸樹粙鏌熼崗鑲╂殬闁糕晛瀚板畷顖濈疀濞戞瑧鍘遍梺缁樏壕顓熸櫠閻㈠憡鐓冮柕澶樺灣閻g敻鏌熼鐣岀煉闁圭ǹ锕ュ鍕偓锝庡€e鑸碘拻濞达絽鎲¢崯鐐寸箾鐠囇呯暤鐎规洖缍婇獮宥夘敊閸撗呭姸闂備礁鎲¢崝锕傚窗濡ゅ懏鍋傞煫鍥ㄦ尨閺€浠嬫煟閹邦厼鐏ラ柛鐕佸灦瀹曟娊鎮剧仦绋夸壕閻熸瑥瀚亸顐ょ磼閼镐絻澹樻い顐㈢箳缁辨帒螣鐠囧樊鈧挾绱撴担鍦槈妞ゆ垵鎳庨埢鎾活敇閵忊檧鎷洪梺鍛婄☉閿曘倝鎮橀埡鍛厸闁告粈绀佹禍鐐翠繆閸欏濮嶉柟顔界懇瀹曨偊宕熼銉㈠亾閸喒鏀介柍钘夋閻忥綁鏌嶅畡鎵閻撱倝鏌熼梻瀵稿妽闁抽攱鍨圭槐鎾存媴婵埈浜濋幈銊╁炊閵婏絼绨婚梺鍝勬储閸斿苯顕i鈧弻鏇㈠幢濡や礁娅ゅ銈忓婢ф骞嗛弮鍫熸櫜闁搞儵顥撴惔濠囨⒒娴g瓔鍤欓柛鎴犳櫕缁辩偤宕卞☉妯硷紱闂佸湱鍎ら〃鍛閸ф鐓忓鑸电☉椤╊剛绱掗悩鑽ょ暫闁哄瞼鍠栭幃娆擃敆閳ь剚鏅堕鐐寸厽闁瑰墽鍋ㄩ崑銏ゆ煛瀹€瀣?濞寸媴绠撻幃娆擃敆閸屻倖效闂佽姘﹂~澶娒哄⿰鍫濆偍鐟滄棃宕洪悙鍝勭闁挎洍鍋撴鐐灪娣囧﹪顢涘☉娆嶄户闂佸摜鍋為悡鈥愁潖婵犳艾纾兼繛鍡樺焾濡差噣姊虹憴鍕偞闁逞屽墯閸撴艾岣块弽顓熺厱闁挎棁顕ч獮鏍煕閵婏妇绠炴鐐寸墬濞煎繘宕滆钃辨俊鐐€ら崑鍛洪悢鐓庤摕闁绘柨鍚嬮崐缁樹繆椤栨粌鍔﹂柟宄扮秺閺岋絾鎯旈姀銏╂殹閻庡厜鍋撻柟闂寸閽冪喖鏌曢崼婵囨悙闁哄鐗撻弻娑樜旈崘銊ょ捕濡炪値鍋€閺呮盯鈥旈崘顔嘉ч煫鍥ㄦ礀閸╁矂姊洪崷顓涙嫛闁稿锕崹楣冨籍閸繄顦ㄥ銈嗘煥濡插牐顦规鐐寸墱閸掓帡宕楁径濠佸闂佽偐鈷堥崜娑樷枖鐠恒劎纾介柛灞捐壘閳ь剛鍏橀幊妤呭礈娴gǹ鐏婂銈嗙墱閸嬫稓绮堟径瀣╃箚闁靛牆鎳忛崳褰掓煟椤撶噥娈滈柡灞剧☉閳藉宕¢悙鎻掝劀婵犵數鍋為幐鎼佲€﹂悜钘夎摕闁哄洢鍨归柋鍥ㄧ節闂堟稒鎼愭繛鍛囧懐纾藉ù锝呮惈灏忛梺鍛婎殕婵炲﹪鐛崘銊庢棃鍩€椤掑嫸缍栨繝闈涱儐閸嬪倿骞栧ǎ顒€鐏憸鏉垮娣囧﹪鎮欓鍕ㄥ亾閹达箑鍨傛繛宸簼閸嬶繝鏌嶉崫鍕櫧鐎规挷绶氶弻娑㈠Ψ椤旂厧顫梺绋款儏椤戝寮诲☉銏╂晝闁挎繂娴傞弳锟犳煟鎼搭澀浜㈤柛瀣姉濡叉劙骞樼拠鑼紲濠殿喗锕╅崗姗€宕戦幘缁樺€婚柤鎭掑劚閳ь剙娼¢弻銊╁即閻愭祴鍋撹ぐ鎺戠柧妞ゅ繐瀚ч弨浠嬫煟濡澧柛鐔风箻閺屾盯鎮╁畷鍥р拰闂佽鍟崱娆戞澑濠电偞鍨跺玻鍧楁偪閸涘瓨鈷戠憸鐗堝笚閿涚喓绱掗埀顒佹媴閾忚锛忛悷婊勬瀵鈽夐埗鈹惧亾閿曞倸绠f繝闈涙川娴滆埖绻濋悽闈涗粶闁绘妫楅锝夊礈娴g懓搴婂┑鐐村灟閸ㄦ椽寮查弻銉︾厱婵炴垵宕弸鐔兼煙椤旂晫鎳囨慨濠冩そ楠炴劖鎯旈姀顫喘闂備礁鎲″褰掑垂閻撳宫娑㈡偄閸忚偐鍘介梺缁樻煥閹芥粓骞婇崘顔藉€垫慨妯煎帶瀵喚鈧娲╃紞鈧紒鐘崇洴楠炴﹢顢涘☉娆愭緫闂傚倷鑳剁划顖濇懌閻熸粍婢橀崯鏉戭嚕閹惰姤鍊烽柣鎴炨缚閸橆亪姊洪幖鐐插姌闁告柨娴风划璇差潨閳ь剟寮诲鍫闂佸憡鎸荤换鍫ユ晲閻愭潙绶炲┑鐐村浮缂傛氨绮诲☉妯锋婵☆垳鈷堝Σ鐑芥煟鎼达紕鐣柛搴″船鐓ら柨鏇楀亾闁伙絿鍏樺畷锝嗗緞瀹€鈧惁鍫ユ⒒閸屾氨澧涘〒姘殜瀹曟洝绠涢弴鐘筹紡闂佽鍨庨崘鈺佲偓顖炴⒑闁稓鈹掗柛鏂跨焷閻忔帡姊洪崨濠勭畵閻庢凹鍙冨畷鎰邦敍濠婂懐锛濋梺绋挎湰濮樸劌鐡梻浣呵归敃銈夋倶濠靛缍栭煫鍥ㄦ⒒缁♀偓濠殿喗锕╅崜娑㈡晬濠婂啠鏀介柣鎰级椤ョ偤鏌涢埡浣哄閸楄鲸銇勯弴妤€浜惧┑顔硷攻濡炶棄鐣烽悜绛嬫晣婵炴垶鐟ラ悵閬嶆⒒娴e懙褰掝敄閸涘瓨鏅濇い蹇撶墛閸嬫ɑ銇勯弮鍌涙珪缂佲檧鍋撻梻浣告啞娓氭宕归幎钘夌骇闁归棿鐒﹂埛鎴︽煕濠靛棗顏€瑰憡绻堥弻娑氣偓锝庡亞濞叉挳鏌熼缂存垹鎹㈠┑瀣倞闁靛ǹ鍎崑鎾绘偨閸涘﹦鍘遍棅顐㈡处閹尖晛危缁嬫5鐟扳堪閸垻鏆┑顔硷攻濡炶棄鐣烽妸锔剧瘈闁告劦鐓堝Σ閬嶆⒒娴e懙褰掝敄閸涱厙娑樷攽閸℃瑦娈鹃梺闈涚箳婵℃潙煤椤忓秵鏅滈梺鍛婁緱娴滄繄鈧艾銈稿娲嚒閵堝懏鐎鹃梺鑽ゅ枂閸庢娊鍩€椤掍礁鍤柛鎾跺枎閻e嘲鈹戠€n€囨煕閳╁啫濮冪紒銊ヮ煼濮婃椽宕崟顒€鍋嶉梺鍛婃煥閼活垶顢氶敐澶樻晪闁逞屽墴瀵寮撮姀鐘茶€垮┑掳鍊撶粈浣糕枔濡ゅ懏鈷戦悹鍥b偓铏亶缂備緡鍠楅幑鍥嵁婵犲洦鍊烽柛婵嗗珋閵娾晜鐓忓璺虹墕閻忊晛霉濠婂牏鐣洪柡宀嬬秮婵偓闁绘ê鍟块弳鍫ユ⒑缂佹ɑ灏柛搴ゅ皺閹广垹鈹戠€n偒妫冨┑鐐村灦閻燁垰螞閿曗偓椤啴濡堕崨顓у妷濡炪們鍔岄幊妯猴耿娴g硶鏀介柣妯款嚋瀹搞儵鎮楀鐓庡闁逛究鍔岄鍏煎緞鐎n剙骞愰柣搴″帨閸嬫捇鏌嶈閸撶喎鐣锋导鏉戝唨妞ゆ挾鍋犻幗鏇㈡⒑闂堟丹娑㈠焵椤掑嫬纾婚柟鍓х帛閺呮煡骞栫划鍏夊亾閼碱剚瀵滄繝鐢靛仜椤曨厽鎱ㄦ导鏉戝瀭闁芥ê顦藉ḿ鏍ㄧ箾瀹割喕绨诲ù鑲╁█閺屾盯寮撮妸銉ョ闂佸憡鏌ㄥ﹢杈╂閹捐纾兼慨妯荤樂閿涘嫮纾奸柤鎼佹涧閸濇椽鏌e☉鍗炴珝鐎规洘锕㈤、娆撴嚃閳轰礁绠伴梻鍌欑閹测剝绗熷Δ鍛偍濡わ絽鍟崑鍌炴煙鐎电ǹ浠х紒鈾€鍋撻梻渚€娼ф蹇曞緤閸撗勫厹闁绘劦鍏欐禍婊堟煙鐎涙ḿ绠栨い銉e灮閳ь剝顫夊ú姗€宕濆▎鎾崇畺婵犲﹤鐗婇崵宥夋煏婢诡垰鍟粻娲⒒娴g儤鍤€闁告艾顑夐幃楣冾敂閸繃妲梺鍛婃处閸ㄤ即鎮块鈧悡顐﹀炊閵娧€濮囬梺缁樻尰濞茬喖寮婚敐鍛傜喖鎼归惂鍝ョ濠电姭鎷冮崨顔芥瘓闂佸搫鐬奸崰鏍€佸▎鎾充紶闁告洦鍋勯~姘辩磽閸屾瑦绁版俊妞煎妿閸掓帒鈻庤箛鏇熸濡炪倖鍔х粻鎴濇暜闂備線娼ч敍蹇旀媴闂€鎰瀳闂傚倸鍊搁崐鎼佸磹閻戣姤鍤勯柛顐f磸閳ь兛鐒︾换婵嬪炊瑜忛灞筋渻閵堝懐绠伴柣妤€锕崺娑㈠籍閸喓鍘遍梺鍝勬储閸斿矂鎮橀悩缁樼厽闁靛牆顦遍悾娲煛瀹€鈧崰鎾舵閹烘嚦鐔告姜閺夊灝鐏侀梻鍌欒兌缁垶寮婚妸銉庢稑鈹戠€n亞鐣洪柣鐔哥懃鐎氼厽鎱ㄥ⿰鍫熺厵鐎瑰嫭澹嗛悞楣冩煕閺傛寧鍤囨慨濠呮缁瑩宕归鍛Ψ闂備焦鎮堕崝灞结缚閳ユ剚鍤曢悹鍥ㄧゴ濡插牊淇婇娑氱煂闁哥姵鐗曢悾宄拔旈崨顓狀槯闂佺ǹ绻楅崑鎰eΔ鈧埞鎴︽偐閹颁礁鏅遍梺鍝ュУ閻楃娀寮崘顔嘉ㄩ柕澶樺枟鐎靛本绻涚€电ǹ孝妞ゆ垵娲ら悾鍨瑹閳ь剟寮诲☉銏犵労闁告劑鍔屽В鍫濃攽闄囩亸顏堝磻閹邦喗顫曢柟鎯х摠婵绱掔€n亞姘ㄩ柛瀣崌楠炴牗绗熼崶銊︽珗濠电姰鍨奸崺鏍礉閺囥垺瀚呴柣鏂挎憸缁犻箖鏌熺€电ǹ浠滈柣鎺戠秺閺屾稓鈧綆鍋呭畷宀勬煛娴g懓濮堥柟顖涙煥閳规垿宕煎┑鍡樼槗闂傚倸鍊风欢姘缚閼姐倗绀婇柍褜鍓氭穱濠囶敃閵忕媭浼冨┑鐘亾濞达絿纭堕弨浠嬫煟濡鍤嬬€规悶鍎甸幃妤€顫濋悡搴$睄閻庤娲橀崝娆撶嵁閸ヮ剦鏁囨繝濞惧亾缂併劌顭峰娲濞戞氨鐣惧┑鈩冨絻鐎氫即骞婇幘璇插瀭妞ゆ棁顫夐弬鈧俊鐐€栧濠氬箠閹惧顩插Δ锝呭暞閳锋帒霉閿濆洦鍤€妞ゆ洘绮庣槐鎺斺偓锝庡亜閻忊晠鏌嶈閸撴岸宕欒ぐ鎺戠婵炲棙鎼╅弫瀣煥濠靛棭妲哥紒鐙€鍣i弻銈夊箒閹烘垵濮夐梺褰掝棑缁垳鎹㈠☉娆愮秶闁告挆鍐ㄧ厒闂備胶顢婇婊呮崲濠靛宓侀柛鈩冪☉闁卞洭鏌i弮鍥仩妞ゆ梹娲熼弻锝夋偐閸欏宸堕梺鍛婁緱閸ㄥ崬鈻撴總鍛娾拻濞达綀濮ら妴鍐磼閳ь剚绗熼埀顒勩€侀弽銊ョ窞濠电姴瀛╃紞搴ㄦ⒑閹呯妞ゎ偄顦遍埀顒佺瀹€鎼佸蓟閵堝洤鏋堥柛妤冨仜椤偄顪冮妶鍡樼叆妞わ箓娼ч~蹇涙惞閸︻厾锛滃┑鈽嗗灣缁垶宕曢幘鍓佺=濞达綀娅g敮娑氱磼鐠囨彃鈧潡銆佸鑸垫櫜闁糕剝鐟ч惁鍫濃攽椤旀枻渚涢柛妯挎閳诲秹寮介鐔叉嫼闂佸憡绋戦敃銉﹀緞閸曨個鐟扳堪閸曨厾鐤勯悗瑙勬礈閸犳牕鐣峰鈧、娆戞喆閿濆棗顏归梻鍌欒兌鏋紒缁樏灋闁秆勵殕閸ゅ銇勮箛鎾跺闁绘挻娲熼獮鏍垝閻熸澘鈷夐梺璇″灠閻楁捇骞楅崼鏇熷€烽柣鎴炨缚閸樹粙姊鸿ぐ鎺戜喊闁告挻宀搁崺銏ゅ即閻旇櫣顔曢梺鍦亾閸撴岸鎮℃總鍛婄厸閻忕偟鍋撶粈瀣偓瑙勬礈閸樠囧煘閹达箑鐐婇柤鍝ヮ暜缁辨帡姊绘担绛嬪殭缂佺粯鍔曢湁婵ǹ娉涢惌妤呮煕閹伴潧鏋涢柦鍐枛閺岋繝宕堕妷銉т患闂備礁宕ú顓㈠蓟瀹ュ绠氶柣妤€鐗忛妴鎰磽閸屾氨孝闁挎洦浜悰顕€宕橀埞鍨簼闂佸憡鍔忛弲娑㈠焵椤掆偓椤兘寮婚敃鈧灒闁绘艾顕粈鍡涙⒑閸愬弶鎯堥柟鍐茬箻閹繝宕橀鐣屽幈濠电娀娼уΛ妤咁敂閻㈠憡鐓涢柍褜鍓氱换婵嗩潩椤撶姴骞愰梻浣告啞娓氭绂嶅┑鍡忔瀺濠电姴鍟崣蹇撯攽閻樻彃顏悽顖涚洴閺岀喎鐣¢悧鍫濇闂佸綊顥撴繛鈧柛銊╃畺瀹曟﹢骞撻幒婵堚偓鎶芥⒒閸屾艾鈧兘鎮為敃鍌氱畺闁割偅娲栫粈澶愬箹濞n剙鐏繛鍛У娣囧﹪濡堕崨顓熸闂佹椿鍘奸ˇ閬嶅焵椤掆偓缁犲秹宕曢柆宓ュ洦瀵奸弶鎴狅紮闂備礁鐏濋鍐╃濠婂牊鐓欓悗娑欋缚缁犳挾绱撳鍡欏⒈缂佽鲸甯℃俊鎼佸Ψ椤旀儳鎮戞繝娈垮枛閿曘儱顪冮挊澶屾殾闁绘垹鐡旈弫鍥煟閹邦厼绲绘い顒€妫濆缁樻媴鐟欏嫬浠╅梺鍛婃煥闁帮絽顕i锝囩瘈婵ǜ鍎崑鎾寸瑹閳ь剙顕i鈧畷濂割敃閿濆棙鐝曢梻鍌欑婢瑰﹪宕戦崱娑樼獥闁规崘顕ч崒銊ッ归悩宸剱闁抽攱鍨块幃宄扳枎韫囨搩浠奸梺鍛婃煟閸婃牠濡甸崟顖氬嵆闁靛ǹ鍎辩猾宥夋⒑缁洘鏉洪柛搴㈠絻椤曘儵宕熼娑樹壕闁挎繂鍟俊铏圭磼閵婎煈鍤欐い顏勫暣婵″爼宕卞Ο铏规闂備礁鎲¢幐鑽ゆ崲閸曨偀妲堥柣銏⑶归柋鍥煛閸モ晛鏋旈柛妯兼暬濮婃椽鎳¢妶鍛€惧┑鐘灪閿曘垽銆侀弮鍫晣闁靛骏绱曢崢闈涱渻閵堝棙绀€闁瑰啿楠搁埢宥咁吋閸ワ絽浜炬繛鍫濈仢閺嬫盯鏌i弽褋鍋㈤柣娑卞枤閳ь剨缍嗘禍鏍绩娴犲鐓欓梺顓ㄧ畱楠炴绱掓笟鍥ф灍缂佺粯绻堥幃浠嬫濞磋翰鍎甸弻鈩冩媴閸涘﹤鏆堥梺閫涚┒閸旀垿銆佸鈧慨鈧柣妯活問閸炵敻姊绘担鍛婂暈闁告棑绠撳畷浼村冀椤愩倗鐒奸柣搴秵閸嬩焦绂嶅⿰鍫熺厵闁逛絻娅曞▍鍛存煃瑜滈崜姘跺箰閹灛锝夊箛椤戣姤鏂€闁诲函缍嗛崑鈧柟椋庣帛缁绘稒娼忛崜褍鍩岄梺纭咁嚋缁绘繈鐛崱娑橀唶闁靛濡囬崢鎼佹⒑閸撴彃浜介柛瀣閺呭爼骞橀鐣屽幍濡炪倖鐗楅懝楣冾敂椤撶喆浜滈柕蹇ョ磿閳藉銇勯锝囩疄闁诡喒鍓濋幆鏃堝閳轰焦鍋戝┑鐘殿暜缁辨洟宕戦幋锕€纾归柡宥庡亝閺嗘粓鏌熼悜妯荤厸闁稿鎸搁~婵嬫偂鎼粹檧鎷梻浣告惈鐞氼偊宕濋幋鐐扮箚闁割偅娲栭獮銏ゆ煛閸モ晛啸闁伙綁绠栧缁樼瑹閳ь剙岣胯閹囧幢濞戞ḿ锛欓梺鍛婄☉閿曪箓銆呴幓鎹ㄦ棃鏁愰崨顓熸闂佺ǹ锕ら悘姘辨崲濞戙垹閱囨繝闈涚墔閾忓酣姊洪崫鍕靛剱闁荤啿鏅犲璇测槈濡粍妫冮崺鈧い鎺戝閻ゎ噣鏌涜椤ㄦ劗绱為弽顓犲彄闁搞儯鍔嶆刊鍏肩箾瀹割喕鎲鹃柡浣稿€块弻娑樷堪閳ь剟鎮為敃鍋瑰宕奸悢铏圭槇闂佹眹鍨藉ḿ褎绂掗敃鍌涚厱闁靛ǹ鍎抽崺锝夋煙椤旀儳鍘存い銏$☉琚欓柛蹇氬亹濞叉挳鏌熼鐣屾噰闁诡喗绮岃灒闂佸灝顑呴鍦磽閸屾瑨鍏岄柧蹇撻叄瀹曘垺绺界粙璺ㄧ枃闂婎偄娲︾粙鎺楀磻閻旀悶浜滈煫鍥ㄦ尵婢ф盯鏌i幘鍗炲姕闁逛究鍔岄~婊堝幢濡も偓缁犲弶绻涚€涙ḿ鐭嬬紒顔芥崌瀵鏁撻悩鑼€為梺鍝勭墢閺佹悂寮弽顐ょ=濞达絽澹婇崕鎾垛偓瑙勬礈閺佺ǹ危閹版澘绠抽柡鍐ㄥ€婚敍婊冣攽閳藉棗鐏ラ柛瀣姍閹箖妫冨☉杈ㄥ瘜闂侀潧鐗嗘鍛婄濠靛牏纾奸悹鍥皺婢э箓鏌曢崱鏇犵獢鐎殿喕绮欓、姗€鎮欓棃娑樼闂傚倷绀佹竟濠囨偂閸儱绐楅柡宥庡弿缂嶆牠鏌涢妷顔煎闁抽攱鍨块弻娑樷攽閸℃浼傚銈庡亾缁犳捇寮诲☉銏犵睄闁逞屽墴瀹曞綊鎮介崜鍙夋櫔闂佹寧绻傞ˇ浠嬪极鐎n喗鐓冪憸婊堝礈閻旈鏆︽繛宸簻閻掑灚銇勯幒宥夋濞存粍绮撻弻鐔兼倻濡櫣浠村銈呯箚閺呮繈鎯€椤忓牆绠氱憸搴ㄥ磻閵夆晜鐓涚€光偓閳ь剟宕伴弽褏鏆︽繝濠傚婵挳鎮峰▎蹇擃伀鐟滄妸鍥ㄧ厽閹兼番鍊ゅḿ鎰版煙閸濄儱鍘撮柟铏殜瀹曞ジ寮撮悙闈涘Е婵$偑鍊栧濠氬磻閹惧墎纾奸柣妯垮皺鏁堥悗瑙勬礃濞茬喖寮婚崱妤冩殼闁靛鍎叉径鍕倵闂堟稏鍋㈢€殿喖鐖奸獮瀣偐閹绘帞鐤勯梻鍌氬€风粈浣革耿闁秴纾块柕鍫濐槸閸氳鎱ㄥΟ鐓庝缓濞存粌缍婇弻鐔兼倻濡闉嶅┑鐐叉噺缁挸顫忓ú顏勭闁圭粯甯婄花浠嬫⒑闂堚晝绁烽柛搴ゅ皺缁骞掑Δ鈧悡娑㈡煕濞戝崬鏋ら柛妯圭矙濮婃椽妫冨☉姘辩暰闂佸搫鎳忛惄顖炲箖濮椻偓閺佹捇鎮╁畷鍥у箺闂備礁鍟块幖顐︽晝閵堝鍊堕柨鏃堟暜閸嬫挸鈻撻崹顔界仌濡炪倖娉﹂崶褏鍙€婵犮垼鍩栭崝鏇綖閸涘瓨鐓熸俊顖濆吹婢с倝鏌¢崨顖氣枅鐎殿喖顭锋俊鎼佸煛娴gǹ绁繝寰锋澘鈧劙宕戦幘瓒佺懓饪伴崼銏㈡毇濠殿喖锕ュ钘夌暦閵婏妇绡€闁告劦浜滃鎶芥⒒娴h櫣甯涢柣妤佹礋婵″墎绮欏▎鎯ф婵犵數濮电喊宥夊磻閸曨垱鐓i煫鍥ㄦ尵缁夋椽鏌嶉悷鎵闁哄矉绲鹃幆鏃堫敍濠婂憛锝嗙箾鐎涙ḿ鐭嬮柣鐔濆洦鍤嶉梺顒€绉甸崑鈺冣偓鍏夊亾闁逞屽墰婢规洟鎸婃竟婵嗙秺閺佹劙宕熼鐘靛幆闂備礁鎲$换鍐渻娴犲绠栧ù鐘差儛閺佸秹鏌曢崼婵囧窛闁伙箑鐗嗚灃闁绘﹢娼ф禒婊堟煕閻曚礁浜伴柛鈹垮灪閹棃濡搁妷褜鍟岄梻浣告啞閸斿繘寮插⿰鍐f瀺鐎光偓閸曨兘鎷绘繛鎾村焹閸嬫捇鏌嶈閸撴盯宕戝☉銏″殣妞ゆ牗绋掑▍鐘绘煙濞堝灝鏋ょ痪鎯у悑閵囧嫰寮崶褌姹楁繝鈷€宥咁洭闁逞屽墲椤煤濮椻偓閺佸啴濮€閵堝啠鍋撴笟鈧顕€鍩€椤掑嫬绠柛娑樼摠閳锋劙鏌熼柇锕€澧绘俊顐g矒濮婄粯鎷呴挊澶婃優闂佸摜濮甸崝娆撳箖閻戣棄唯鐟滃宕戦幘鎰佹僵闁绘挸楠哥粻鑽ょ磽娓氬洤鏋涢柣妤佹尭閻i攱绺界粙璇俱劑鏌ㄩ弮鈧崕鎶界嵁閹邦兘鏀介柣鎰煐瑜把呯磼闊厾鐭欐鐐诧工閳诲酣骞橀弶鎴滅敾闂備礁鎼ˇ鍐测枖閺囥垹围妞ゆ劧闄勯埛鎺楁煕鐏炲墽鎳呮い锔奸檮缁绘繈鍩€椤掍焦缍囬柕濠忛檮閻濆嘲鈹戞幊閸婃劙宕戦幘娣簻妞ゆ挾鍋熸禒銏ゆ懚閿濆鐓犳繛鏉戭儐濞呭啰绱掑Δ鈧ˇ闈涱潖濞差亜绠氱憸搴g矉鐎n喗鐓曢悗锝庝簻閳ь剙顭烽獮鎴﹀閵堝懎鑰垮┑鐐村灦閻熝囧储椤忓牊鈷戦柛鎾村絻娴滄繄绱掔拠鎻掓殶闁逞屽墯閼归箖骞婂鈧濠氭晸閻樿尙鍔﹀銈嗗笂閼冲墎寮ч埀顒€鈹戦鏂や緵闁告﹢绠栧畷銏ゅ箹娴e厜鎷洪梺鍛婄☉閿曪絿娆㈤崡鐏荤懓饪伴崟顓犵暤闂佸疇顕х粔鐢垫崲濠靛绀冮柍杞扮娴煎骸鈹戦悩鍨毄濠殿喗鎸冲畷顖烆敍閻愬弬锔界節闂堟稓澧愰柛瀣尵閹叉挳宕熼鍌ゆО婵$偑鍊戦崝宀勬晝閵堝缍栭煫鍥ㄧ⊕閸ゆ帡鏌曢崼婵囧婵☆偅绮撻弻锝嗘償椤栨粎校婵炲瓨绮庨崑銈呯暦濠靛鍋ㄩ柛娑樑堥幏濠氭⒑缁嬫寧婀伴柣鐔村姂瀹曟鐣濋崟顐㈠殤濡炪倕绻愰悧濠囧煕閹达附鍋ㄦい鏍电到閺嬨倗绱掔€n厼鍚圭紒杈ㄥ浮瀹曟帒顫濆В娆嶅€濋弻鐔兼偡閺夋浠剧紓浣诡殘閸犳牠銆佸☉姗嗘僵妞ゆ挆鍐╁亼闂傚倸鍊搁崐椋庣矆娓氣偓楠炲鏁撻悩鑼槷闂佸搫娲ㄩ崕鎰板吹閺囩喆浜滈柟鐑樺灥椤忊晝绱掗銏⑿ч柡灞剧洴椤㈡洟鏁愰崶鈺冩毉婵$偑鍊х拹鐔煎礉瀹€鍕ㄢ偓鏃堝礃椤斿槈褔鏌涘☉鍗炵仯妞ゆ柨娲ら埞鎴﹀煡閸℃ぞ绨诲銈嗘处閸樼厧宓勯梺鍦濠㈡ḿ绮堥崘鈺冪闁哄鍩堥崕鎰版煛閸屾浜鹃梻鍌氬€烽懗鍓佸垝椤栫偛绀夋慨妞诲亾鐎规洘妞藉浠嬵敄閸欍儲鐫忛柣鐔哥矊缁绘帒危閹版澘绠虫俊銈勭濞堛倝鏌i悩鑽ょ窗婵℃ぜ鍔屾晥婵°倕鎳忛埛鎴︽煕濞戞﹫宸ョ紒妤佸哺閹粙顢涘☉妯昏癁闂佺硶鏂傞崹娲箚閺冨牆惟闁靛/灞芥櫔闂傚倷鑳舵灙缂佺粯鍔欓獮濠囧箛閻楀牆鈧嘲鈹戦悩鎻掓殶缂佲檧鍋撻梻浣圭湽閸ㄨ棄岣胯缁傛帒饪伴崟顏嗙畾濡炪倖鐗楅悢顒勫绩閼姐倗纾奸柛灞炬皑瀛濋梺瀹狀潐閸ㄥ綊鍩€椤掑﹦绉甸柛瀣缁傚秴螖閳ь剟鍩為幋锔藉€烽柛娆忣樈濡繝姊洪崷顓€褰掆€﹂悜钘夌畺闁跨喓濮甸崑鍕煕韫囨艾浜归柛妯圭矙濮婃椽宕崟顐熷亾閸︻厸鍋撶粭娑樻搐缁犳岸鏌涢銈呮瀭濞存粍绮撻弻銊モ攽閸℃ê娅¢梺绋款儍閸ㄤ粙寮婚垾宕囨殕闁逞屽墴瀹曚即寮借閺嗭附淇婇妶鍛櫤闁稿鍊块獮鏍垝鐟欏嫷娼戝┑鐐插悑瀹€绋款潖缂佹ɑ濯撮柛娑橈攻閸庢捇姊哄ú璇插箹妞わ箒浜Σ鎰版倷鐎靛摜鎳濋梺閫炲苯澧い鏇秮椤㈡洟鏁冮埀顒傜不濞戙垺鐓涘璺猴功娴犮垻绱掗幇顓犫槈妞ゎ亜鍟存俊鍫曞幢濡儤娈梻浣告憸閸犳劙鏁冮姀銈呮槬闁斥晛鍟伴悷褰掓煕閵夛絽濡奸柣锔界矒濮婄粯绗熼埀顒€岣胯閹囧幢濮楀棙顔旈梺鍛婄☉閿曪箓銆呴崣澶岀瘈闂傚牊绋撴晶銏㈢棯閹冩倯闁靛洤瀚板顕€宕堕‖顔芥尵閳ь剝顫夊ú鏍儔婵傜ǹ鐒垫い鎺戝枤濞兼劖绻涢崣澹濐亪鈥旈崘鈺冾浄閻庯綆浜濆Σ顒勬⒑闁偛鑻晶顖炴煏閸パ冾伃妤犵偞甯掗鍏煎緞鐎g鍋撻弽銊х閻庢稒岣块惌瀣磼椤旇姤宕岀€殿喖顭烽幃銏ゅ礂閻撳簶鍋撶紒妯圭箚妞ゆ牗绻冮鐘裁归悩铏稇妞ゎ亜鍟存俊鍫曞川椤栨粎鏆伴梻浣告惈閹虫劖绻涢埀顒傗偓娈垮枛椤兘寮幘缁樺亹闁肩⒈鍓﹀Σ褰掓⒒娴e摜鏋冩俊妞煎妿缁牊鎷呯憴鍕伎闂佹寧娲栭崐褰掑煕閹达附鐓曟繝闈涙椤忣剟鎮楀顓烆棆缂佽鲸甯楀鍕節閸曨厜銊╂倵鐟欏嫭绀冩俊鐐扮矙瀹曟椽宕熼姘鳖槰闂佸疇妗ㄧ欢锟犲焵椤掍焦宕屾慨濠冩そ瀹曘劍绻濋崟銊︻潔闂備焦瀵уú蹇涘磿閻㈡悶鈧礁鈻庨幇顒傜獮婵犵數鍋熼崑鎾诲棘閳ь剟姊绘担铏瑰笡閽冮亶鏌涢幘鏉戝摵鐎规洦鍨电粻娑樷槈濞嗘垵骞堥梻渚€娼ц墝闁哄懏鐟╅獮澶愭倷椤掑顔旈梺缁樺姈濞兼瑦鎱ㄥ鍥e亾鐟欏嫭绀冮柨姘亜閺傝法绠绘い銏$懇瀹曟鍠婇崡鐐村亼闂傚倸鍊搁崐椋庣矆娴e湱鐝跺┑鐘叉搐绾惧鏌涘☉鍗炲Ц闁告繂瀚峰ḿ銊╂煃瑜滈崜娆撴偩閻戣棄绠涢柣妤€鐗嗛埀顒€顭烽弻銈夊箒閹烘垵濮夐梺鐟板槻椤嘲顫忓ú顏勭闁圭粯甯婄花浠嬫⒑閸濄儱孝缂佸娉涢埢搴ㄥ閵堝棛鍔堕悗骞垮劚濡盯宕㈤幖浣光拺缂侇垱娲橀鍡涙煛閸涱喚鈽夋い鏇秮椤㈡瑩鎳為妷銉ヤ紟濠电姷鏁告慨鎾箠韫囨侗鏁傞柣妯兼暩绾惧吋銇勯弮鍌涙珪闁瑰啿鍟撮弻宥囨嫚閺屻儱寮板Δ鐘靛仜濡粓藝閹绘帩鐔嗛柣鐔稿婢э附鎱ㄦ繝鍕笡闁瑰嘲鎳忕粭鐔碱敍濞戞瑦娈插┑鐘垫暩閸嬫盯骞婅箛鎾佹椽鎮㈤悡搴㈢€柣搴秵娴滆泛銆掓繝姘厪闁割偅绻堥妤€霉濠婂嫮鐭岀紒杈ㄥ笧缁辨帒螣閾忛€涙偅闂備胶鎳撶粻宥夊垂瑜版帒鐓橀柟杈剧畱楠炪垽鏌嶉崫鍕偓鎼佸礂婵犲啩绻嗛柣鎰典簻閳ь剚鐗滈弫顕€骞掑Δ鈧壕璇测攽閻樻彃顏い顐f礋閺屾稑鈻庤箛锝喰ㄧ紓浣叉閸嬫捇姊绘担鍦菇闁搞劏妫勫玻鑳槼缂佸倹甯掗オ浼村礋椤忓棛鐣炬俊鐐€栭崝褏寰婇崸妤€绠犻柛銉㈡杹閸嬫挾鎲撮崟顒傤槰缂備浇顕ч崐浠嬫倶閸愵喗鈷戦柛娑橈梗缁堕亶鏌涘Ο鑽ゆ噯妞わ箑缍婇弻锛勪沪缁嬪灝鈷夐悗鍨緲鐎氼厾鎹㈠┑瀣妞ゆ帒鍊归濠氭⒒閸屾瑦绁伴柕鍡忓亾闂佺ǹ顑嗛幐鎼佹箒闂佺粯锚濡﹪宕曢幇鐗堢厽闁规儳鍟块弳锝夋煛鐏炵晫校婵炵⒈浜獮宥夘敋閸涱啩婊堟⒒娴e憡鎯堟俊顐g懇瀵濡搁埡鍌滅暢闂傚倷鑳剁划顖炴晝閵忕姫缂氱憸鏃堝春閵忋倕閱囬柕澶涘閸樻悂鏌h箛鏇炰粶濠⒀嗘鐓ら悗鐢电《閸嬫挸鈻撻崹顔界彯闂侀潻缍囩紞浣哥暦濞差亜鐒垫い鎺嶉檷娴滄粓鏌熼悜妯虹仴妞ゅ繆鏅犻弻娑㈠Ω閵夈儮鍋撻崸妤€钃熼柨婵嗩槸椤懘鏌曢崼婵囶棛婵﹫濡囩槐鎾诲磼濮樻瘷锝夋煟濡ゅ啫鈻堥柟顕嗙節椤㈡洟鏁冮埀顒勬倷婵犲洦鐓忓┑鐐戔偓閸嬫挸鈹戦鍏煎枠闁哄矉绲鹃幆鏃堟晲閸℃ɑ鐦庡┑鐘愁問閸犳骞愰幎钘夌伋闁挎洖鍊搁柨銈嗕繆閵堝嫮顦︽繛鍫熺箞閹鎮介棃娑辨毉濡炪們鍔岀换鎴犵矉瀹ュ鏁傞柛顐犲灩缁侊箓姊洪崨濠傚Е闁哥姵鐗滅划濠氭晲婢跺鍘介梺褰掑亰閸犳寮抽埡鍛厽闁挎洍鍋撻柣妤佹尭椤繐煤椤忓拋妫冨┑鐐村灟閸ㄨ鐣烽鍡欑=濞达絿鎳撶徊璇差熆瑜戝Λ鍕煡婢舵劕鍨傛い鎰Т娴滄繈姊洪崨濠傚闁哄懏绻堝畷锝夊幢濞戞瑢鎷洪梺鍛婄箓鐎氼厾绮婇埡浼辩懓饪伴崨顓濇闂佽鍣g粻鏍箖娴犲宸濆┑鐘插楠炴劕鈹戦悙鑸靛涧缂佽弓绮欓獮妤€饪伴崘顏呮噧闂傚倸鍊风粈渚€鎮块崶顒夋晪鐟滃秹锝炲┑瀣櫆闁告挆鍌滅憹婵犵數鍋為崹鍫曟偡瑜忓褔鍩€椤掑嫭鈷戦柛娑橈工婵偓闂佸搫鎳忕划宀勨€﹂崸妤€绠i柨鏃囆掗幏濠氭⒑缁嬫寧婀伴柣鐔村姂瀹曟鐣濋埀顒傛閹烘鏁嬮柛娑卞幘娴犫晠姊虹紒妯肩煄鐎规洜鏁婚獮鎴﹀礋椤栨鈺呮煏婢跺牆鍔ゅù婊呭娣囧﹪鎮欓鍕ㄥ亾閺嶎厽鍋嬫俊銈呮噹閺勩儵鏌涢幇鈺佸闁挎繂顦柋鍥煏韫囧ň鍋撻搹顐も偓楣冩⒑閻熸澘鎮戦柣锝庝邯瀹曟繄浠︾紒銏℃暞闂傚倸鍊风粈渚€骞夐垾瓒佹椽鏁冮崒姘€梺瑙勵問閸犳碍绋夊澶嬬叆婵犻潧妫欓ˉ鐘电磼閳锯偓閸嬫捇姊婚崒姘偓鎼佹偋婵犲嫮鐭欓柟鐑樻尭缁剁偤鏌涢弴銊ョ仭闁绘挻鐟﹂妵鍕籍閸屾稒鐝梺鐟板暱濞诧箓骞堥妸锔剧瘈闁告洦鍋勬俊娲煟鎼达絾鏆╅柛妯犲洤鐓濋幖娣妼缁狅絾绻濋棃娑欘棤闁告ɑ甯″濠氬磼濞嗘劗銈板銈嗘肠閸涱喖搴婇梺鐟扮摠缁诲秴岣块埡鍛厪濠电倯鍐ㄦ殭闁诲繐锕ら—鍐Χ閸℃ê钄奸梺鎼炲妽濡炶棄鐣烽幋锕€绀嬫い鏍ㄧ〒閸樹粙姊虹憴鍕婵炲懏娲熼獮鎴︽晲婢跺鍘遍梺鍝勫暞閹搁箖鎮炬潏銊d簻妞ゅ繐瀚弳锝呪攽閳ュ磭鍩g€规洖宕灃闁告劦浜濋崳顖炴⒒娴g瓔鍤欓悗娑掓櫊瀹曟瑨銇愰幒鎴狀槶濠电偞鍨堕懝楣冨垂濠靛棌鏀介柣妯虹枃婢规﹢鏌涢幇銊ヤ壕闂傚倷绶氬ḿ褎鐏欓梺绋匡攻椤ㄥ牏鍒掔拠宸僵闁煎摜顣介幏娲⒒閸屾氨澧涚紒瀣尰閺呭爼寮撮姀锛勫幍闂佸憡鍔樼亸娆戠不閼姐倐鍋撶憴鍕闁哥喕娉曢崣鍛渻閵堝懐绠伴柟铏姍瀹曘垽骞栨担鍏夋嫼闂佸憡绋戦敃锝囨闁秵鐓曢柣妯哄暱閸濊櫣鈧娲╃紞渚€宕洪埀顒併亜閹哄棗浜鹃柧缁樼墵閺岋絽顫滈埀顒€岣胯缁傛帡鏁冮崒娑氬幗濠德板€撻懗鍫曟儗閹烘柡鍋撶憴鍕鐎光偓閹间胶宓侀柟鐑樺殾閺冣偓閹峰懘姊归幇顔芥毎闂傚倸鍊风粈渚€骞栭位鍥敍濠婂棗小闂備緡鍓欑粔瀵哥不椤栫偞鐓忛柛顐g箥濡插綊鏌嶉柨瀣瑨闂囧鏌ㄥ┑鍡樺窛闁硅棄鍊块弻娑㈠Χ閸℃瑦鍣紓浣介哺鐢偟妲愰幒鎳崇喖宕崟鍨秿缂傚倸鍊风欢锟犲窗濡も偓铻為柛鎰靛枛缁犳牠鏌i幋锝呅撻柣鎺嶇矙閺屻劑寮崒娑欑彧缂備礁顑勭欢姘潖缂佹ɑ濯撮柣鐔告緲婵垻绱撴担铏瑰笡闁告梹娲熼弫鍐閵堝棛鍔堕悗骞垮劚濡宕滈悷鎵虫斀闁绘劕寮堕ˉ鐐烘煕閺冣偓椤ㄥ牏鍒掔紒妯稿亝闁告劏鏅濋崢閬嶆⒑閺傘儲娅呴柛姗€绠栭、鏃堝醇濠靛牜妲烽梻渚€娼ч悧鍡浰囨导瀛樺亗闁哄洢鍨洪悡娆撴煙鐟欏嫬濮堢痪顓熷劤闇夋繝濠傚暙閳锋梻绱掓潏銊ョ缂佽鲸甯掕灒缂佹銆€閸嬫捇骞掑Δ浣哄帗閻熸粍绮撳畷婊冾潩鏉堚晝鐓撻梺鍦劋閸ㄥ綊鐛幘缁樼厱鐟滃酣銆冮崱娑樼?婵°倕鎳忛崐鐢告煥濠靛棝顎楀褎澹嗛惀顏堝箚瑜嬮崑銏ゆ煙椤旇偐绉虹€规洖鐖奸、鏃堝礋椤撶噥鍤勬繝鐢靛Л閹峰啴宕熼娑欘潔闂佸吋瀵ч崝娆撳蓟濞戙垹唯闁瑰瓨绻勫暩闂佸憡鍑归崑濠傤潖閾忚瀚氶柍銉ㄦ珪閻忔捇姊洪崫鍕闁稿妫濆畷姘跺箳閹存梹鐎婚梺鐟邦嚟閸嬫稓澹曢姘兼富闁靛牆楠搁獮妤呮煕閵娿劌鐓愰柡鍛劚閳规垿鎮╁▓鎸庢缂備浇椴稿ú鐔风暦閹达箑绠i柨鏇楀亾缁炬儳缍婇弻鈥愁吋鎼粹€崇闂佺ǹ顑呴鍡樼┍婵犲洤围闁告侗鍠栧▍銈夋⒑閹肩偛鈧洟鎳熼婵堜簷闂備焦瀵х换鍌炲箠鎼淬劌姹叉繛鍡樻尰閻撶姷绱掔€n厽纭剁紒澶嬫そ閺岋紕浠﹂悙顒傤槰缂備胶绮惄顖炲箖濞嗘搩鏁嗗ù锝呮惈缁查箖姊婚崒娆戝妽濠电偛锕銊╂焼瀹ュ懎鐎梺鍓茬厛閸n喖岣块弽褉鏀介柣妯虹枃婢规﹢姊洪崡鐐村枠闁哄矉缍佸顕€鍩€椤掑嫬纾垮┑鍌溓圭憴锕傛煕鐏炴儳鐒归柡鈧禒瀣厽闁归偊鍘界紞鎴︽煟韫囥儳鐣甸柡宀嬬秮椤㈡ǹ顦查柡瀣洴閺屽秶鎷嬪畷鍥╃厯濡炪們鍨哄Λ鍐ㄧ暦婵傚憡鍋勯柛婵嗗缁犳椽姊婚崒娆戠獢闁逞屽墯缁嬫垵鐣甸崱妯肩濞达絽鍟跨€氼厼鈻嶉悩娴嬫斀闁绘ê纾。鏌ユ煟閹惧瓨绀嬮柡宀嬬秮瀵噣宕奸悢鍛婃濠电姰鍨煎▔娑氣偓姘煎枤濡叉劙骞掗弮鍌滐紲濠碘槅鍨甸崑鎰版偩婵傚憡鈷戦柛婵勫劚瀛濋梺鎸庢磸閸庨亶顢氶妷鈺佺妞ゆ劑鍊栧▓鏇㈡⒑闁偛鑻晶鎾煛娴e摜效闁诡喓鍨藉畷妤冧焊閺嶃劌顏圭紓鍌氬€风粈渚€顢栭崱娑辨晞婵炲棙鎸哥壕鍧楁煙閹殿喖顣奸柣鎾存礋閺屾洘绻涢崹顔煎Б婵炲濮伴崹浠嬪蓟閿濆鏅查柛銉戝啫绠f俊銈囧Х閸嬫稑煤椤撶儐鍤曢柛顐f礀閸ㄥ倹銇勯弬鍨倯闁哄棗绻愰埞鎴︽晬閸曨偂鏉梺绋匡攻閻楃娀鐛幇顓滃亝闁告劑鍔庨敍娑㈡⒑缂佹〒褰掝敋瑜忕划璇裁洪鍛幐闂佹悶鍎崕閬嶆倶椤忓牊鐓冮梺鍨儏閻忓瓨鎱ㄦ繝鍌ょ吋鐎规洖銈搁幃銏㈡嫚閹绘帒顥庨梺鑽ゅ枑缁孩鏅跺Δ鍐╂殰闁圭儤鏌ㄩˉ姘舵偣閹帒濡烽柛瀣崌閻涱噣宕归鐓庮潛闂備浇顕栭崰鏍倶濠靛牆寮叉俊鐐€曠换鎰矓閻㈢ǹ鐤炬繝濠傜墛閸婂灚顨ラ悙鑼虎闁告梹纰嶆穱濠囶敃閿濆洦鍣ч梺瀹狀嚙缁夋挳顢橀崗鐓庣窞閻庯急鍕伜婵犵數鍋犻幓顏嗙礊閳ь剚绻涢崪鍐偧闁轰緡鍠栭埥澶愬閿涘嫬骞堥梻渚€娼ц墝闁哄懏绮岄埥澶庮樄闁硅棄鐖奸幃娆戔偓闈涙憸椤旀洟姊虹化鏇炲⒉闁挎岸鏌h箛濠冩珖缂佽鲸甯¢崺鈧い鎺嶈兌缁♀偓闂佹悶鍎滈崪浣告櫍缂傚倸鍊风欢锟犲窗濞戭澁缍栧鑸靛姦閺佷線鏌涢埄鍐姇闁绘挻鐩弻宥堫檨闁告挻姘ㄧ划瀣箳閺傚搫浜鹃柨婵嗛娴滅偤鏌涘Ο鍦煓婵﹪缂氶妵鎰板箳閹存粌鏋堥梻浣告啞閹稿鎮疯閹偓妞ゅ繐娴傚Ο鍕⒑閸濆嫯瀚扮紒澶婂濡叉劙骞掗幊宕囧枛閹筹繝濡舵惔鈶挎岸姊婚崒姘偓绋棵洪妶澹﹀洭骞嶉钘夊簥濠电娀娼уú銊у姬閳ь剟姊虹粙鎸庢拱闁告垼顫夌€靛ジ鍩€椤掑嫭鈷掑ù锝堫潐閵囩喖鏌涘Ο鎭掑仮闁轰礁鍟存俊鐑藉煛娴e嫸绠撻弻娑㈠即閵娿儳浠╁┑鈽嗗亝閿曘垽骞冭ぐ鎺戠畳闁圭儤鍨甸‖瀣渻閵堝棙鐓ユ繛宸幖椤繘鎼归崗澶婁壕闁革富鍘奸灞剧箾閸忕厧濮嶉柡灞剧洴婵℃悂濡疯閾忓酣姊烘导娆戠М闁衡偓閸楃偍缂氶煫鍥ㄤ緱閺佸啴鏌曢崼婵囧婵犮垺鍨垮缁樻媴閸涘﹥鍎撻梺鍝ュ枔婵炩偓鐎规洘鍨块獮妯肩磼濡厧骞愬┑鐘灱濞夋盯顢栭崱娑樼9闁归偊鍘介崣蹇撯攽閻樻彃顏悽顖涚洴閺岀喎鐣¢悧鍫濇畻闂佸湱鍘х紞濠囧箖閻戣棄绠ユい鏇炴噹娴犲綊姊婚崒娆愮グ婵☆偄瀚板畷顖炴惞椤愩値娲稿銈嗗笒鐎氼剛绮婚悢鍏肩厵闂傚倸顕ˇ锔剧磼閻欐瑥娲﹂悡鏇熴亜椤撶喎鐏ラ柡瀣枑缁绘盯宕奸敐搴℃濡炪値浜滈崯瀛樹繆閸洖绀冮柕濞у倻妫┑鐘殿暯濡插懘宕戦崟顖氱柈闁圭虎鍠栬繚婵炴挻鍩冮崑鎾垛偓娈垮櫘閸o絽鐣烽悡搴樻斀閻庯綆浜濋弳顏堟⒒閸屾瑨鍏岀紒顕呭灦瀵濡搁埡浣侯啇濡炪倖鍔ф俊鍥х暤娓氣偓閺屾盯顢曢悩鎻掑闂佹娊鏀辩敮鎺楁箒闂佹寧绻傚ú锕傚吹閳ь剙顪冮妶鍡樼缂侇喖娴峰Σ鎰板箳閺冣偓鐎氭岸鏌熺紒妯哄潑闁稿鎹侀妵鎰板箳鐎Q冧壕闁告劦鍠栧敮閻熸粌绻橀幆灞解枎閹邦喚顔曢梺绯曞墲閿氶柛鏂诲€栫换娑㈠醇濞戞ê顬堝銈庝簻閸熷瓨淇婇崼鏇炲耿婵妫欓埛鏍р攽閻樻剚鍟忛柛鐘虫崌瀹曟劕鈹戦崱娆愭闂佹寧绻傞悧蹇涙偪閳ь剟姊洪崷顓℃闁搞劑浜跺顒勫焵椤掑嫭鈷掑ù锝堟鐢盯鎷戞潏鈺傚枑闁哄鐏濋弳锝団偓娈垮枟婵炲﹪骞冨▎鎾村€绘俊顖滃帶鐢箖姊绘担瑙勫仩闁稿寒鍨跺畷婵囨償閿濆洣绗夐梺鍝勭Р閸斿﹥绂嶅⿰鍫熺厪濠电姴绻掗崚浼存煕閺冩挾鐣甸柡宀€鍠栭、娆撴偩鐏炴儳娅橀梻渚€鈧偛鑻晶浼存煛娴e憡鍟為柣蹇旂懇濮婃椽宕橀幓鎺撔╅梺娲诲幖閸婃悂锝炶箛娑欐優閻熸瑥瀚悵浼存⒑閻愯棄鍔ユ繛鍛礋閹ê顓兼径瀣ф嫼闂佺厧顫曢崐鏇㈠汲闁秵鐓涢柛娑卞灠閳诲牓鏌熼璇插祮妞ゃ垺宀搁崺鈧い鎺戝瀹撲焦淇婇姘倯閻庢碍宀搁弻銈囧枈閸楃偛鈷掗梺鍝ュ仧閸庛倗鎹㈠┑瀣仺闂傚牊绋堥弸鍛攽閻愭澘灏冮柛蹇曞У濡炶姤淇婂宀婃Ь闂佹椿鍘介幑鍥ь潖濞差亶鏁嗛柍褜鍓涚划鏃堟偨缁嬭法鍘遍梺鍦劋椤ㄥ棝鎮¢弴銏″€堕柣鎰綑缁€鍐熆鐟欏嫸鑰块柡灞界Х椤т線鏌涢幘瀵告创鐎规洘顨呴~婊堝焵椤掑嫮宓佸┑鐘蹭迹閺冨牆宸濇い鏂垮悑閻ゅ倿姊绘担鍦菇闁搞劌缍婂畷銉╁焵椤掑倻纾兼い鏃囧Г缂嶆垿鏌嶇憴鍕伌闁轰礁绉瑰畷鐔碱敃閳╁啯绶氶梻鍌欒兌鏋柨鏇樺劦閹囨偐閼碱剚娈鹃悷婊呭鐢藟閸喓绠剧痪鎯ь儐閻濐亞绱掔€n偄鐏撮柛鈺冨仱楠炲鏁冮埀顒勭嵁閵忥紕绠鹃柛鈩兠慨鍫熴亜閺冣偓濞叉ḿ鎹㈠┑瀣仺闂傚牊绋堥弸鍛攽閻愭澘灏冮柛銉ㄥ煐閺呯偤姊洪崨濠勨姇婵炲吋鐟у☉鐢稿焵椤掑嫭鈷戦悷娆忓閸旇泛鈹戦鍝勨偓婵嬪箖闄囩粻娑樷槈濮橆剙绲奸梻浣规偠閸庮垶宕濆鍥╃焼闁逞屽墴閺屾盯鎮㈤崨濠傗偓鎰叏婵犲啯銇濈€规洏鍔嶇换婵嬪礋椤掆偓閺嬶箓姊绘担鍛靛綊顢栭崱娑樼闁煎鍊栧畷鍙夌節闂堟侗鍎愰柛瀣ㄥ姂濮婂宕奸悢宄扮€梺缁樺姉閸庛倝鎮¢弴銏$厪濠电偛鐏濋崝姗€鏌涚€c劌鐏柍褜鍓濋~澶娒哄Ο渚富闁芥ê顦介崵鏇灻归悩宸剾闁轰礁娲弻锝夊箛椤撗冩櫛濠德ゅ皺閸忔ê顫忕紒妯诲闁告稑锕ラ崕鎾剁磽娴e壊鍎庣紒鑸佃壘閻g兘濮€閵堝棗娈愰梺瀹犳〃缁垛€澄涘⿰鍕瘈闁汇垽娼ф牎缂佺偓婢樼粔褰掑箖闄囩粻娑㈠箻椤栨稒鏉搁梻浣虹帛閸旀牠宕归悽绋跨柈妞ゆ牜鍋涢梻顖毭归悩宸剱闁绘挶鍎茬换娑㈠箣閻愬灚鍣梺娲诲幗鐢繝寮婚垾宕囨殕閻庯綆鍓涜摫闂備浇顕栭崹鍗炍涢崘顔衡偓浣糕槈濡嘲鐗氶梺鍛婄☉閹锋垹绱炴担鍓叉綎婵炲樊浜滃婵嗏攽閻愬灚娅曠紒鍙樺嵆濮婃椽宕崟顒€顎涢梺绋款儏鐎氫即宕洪妷锕€绶為柟閭﹀幖娴犺櫣绱撴担鍓插剰婵炵》绻濆畷顒勫醇閺囩啿鎷洪梺鍛婄箓鐎氼厼顔忓┑瀣厱闁绘ǹ娅曞畷宀€鈧娲忛崹浠嬪蓟閸℃鍚嬮柛鈥崇箲鐎氬ジ姊绘担鍛婂暈缂佽鍊婚埀顒佸嚬閸撶喎顕i幎鑺ュ€烽柣鎴炨缚閸樼敻姊鸿ぐ鎺擄紵闁煎啿鐖奸幃鎯洪鍛幍濡炪倖姊归崕铏閻愵剛绠鹃柣鎾虫捣缁犺鈹戦埄鍐╁€愰柡浣瑰姍瀹曠喖顢橀悩铏珤濠电姷顣槐鏇㈠磻閹达箑纾归柡鍥╁У瀹曟煡鏌熼柇锕€鏋撻柛瀣尭椤繈鎮℃惔鈾€鎷柣搴㈩問閸犳绻涙繝鍥ф瀬闁圭増婢樺婵囥亜韫囨挻鍣洪柡澶嬫倐濮婄粯鎷呴崫鍕紦闂佺ǹ姘︽禍顒佺珶閺囥埄鏁囬柕蹇曞У濡差剟姊洪幐搴g畵婵炶尙濞€瀹曟垿骞橀懜闈涙瀭闂佸憡娲﹂崜娑⑺囬妷鈺傚€甸悷娆忓婢跺嫰鏌涢幘瀵哥疄闁诡喗锕㈠畷姗€顢欑憴锝嗗闂備礁鎲$粙鎴︽晝閵堝棙鍙忛柨鏇楀亾闂囧绻濇繝鍌氼伀缂佺姷鍋熼埀顒冾潐濞叉ɑ绻涙繝鍥モ偓浣糕槈閵忊€斥偓椋庣磼椤旀娼愰悗姘虫閳规垿鎮欓懜闈涙锭缂備焦褰冨ḿ锟犲箖濞差亜绫嶉柛顐g箓閹偛鈹戦悙鍙夘棡闁圭ǹ顭峰畷鎰板垂椤愩倗顔曢梺鐟邦嚟閸嬫稓绮顓犵闁告侗鍙忛崝鐔兼煃瑜滈崜婵嬶綖婢跺⊕鍝勵潨閳ь剟骞冮悜钘壩╅柍杞扮导閿曞倹鐓欓柣妤€鐗婄欢鑼磼閻樺啿鈻曢柡宀€鍠撻埀顒傛暩鏋崯鎼佹⒑閸涘⿵渚涢柛鎾跺枎椤繒绱掑Ο璇差€撻梺鍛婄☉閿曘倝寮抽崼銉︹拺闁告稑锕ラˉ鏍磼閻樿櫕灏柣锝夋敱鐎靛ジ寮堕幋婵嗘暏婵$偑鍊栭崝鎴﹀磹閹惧墎绠斿鑸靛姈閳锋垿鏌涘┑鍡楊伀闁宠顦甸弻娑樜熼崷顓犵厯闂佽鍣换婵囦繆閻戣棄鐓涢柛灞剧矊楠炴姊绘担鍛婃儓闁稿﹤婀遍埀顒傜懗閸パ呯暰闂佸壊鍋侀崕閬嶅礃閳ь剟姊虹捄銊ユ灁濠殿喚鏁婚崺娑㈠箣閻樼數锛滈柣搴秵閸嬫帡宕曢妷鈺傜厱閹艰揪绱曠粻濠氭煙椤旂瓔娈旀い顐g箞椤㈡洟濮€閻樼偣鍋栭梺璇插椤旀牠宕板☉銏╂晪鐟滄棃宕洪妷锕€绶炲┑鐐灮閸犳牠寮婚妸褉鍋撻敐鍛粵缂傚秴鑻埞鎴︽偐閹颁礁鏅遍梺鍝ュУ椤ㄥ﹪濡撮崘顔煎窛閻庢稒锚娴滈亶姊虹化鏇炲⒉闁挎碍銇勯弴顫喚闁哄瞼鍠栭獮宥夘敊绾拌鲸姣夐梻浣呵归敃銈夋倶濮樿鲸宕叉繛鎴欏灩闁卞洦绻濋棃娑氬闁惧繐閰e娲传閸曢潧鍓遍梺鐑╂櫓閸ㄨ泛顕f繝姘櫜闁割偁鍨婚弶鎼佹⒑閸濆嫬鏆欓柛濠傤煼閹潡宕熼娑掓嫼缂備緡鍨卞ú妯衡枍閸ヮ剚鐓曢悗锝冨妼閳ь剚绻堥幃浼搭敊闁款垰浜鹃柨婵嗛閺嬬喖鏌¢崨顔剧疄闁哄苯绉烽¨渚€鏌涢幘璺烘灈妤犵偛鍟撮弫鎾绘偐閾忣偅顏熼梻浣虹帛閿氱痪缁㈠弮瀹曘垽鏌嗗鍡忔嫼闂佸搫鍊堕崕鎻掆枍閸涘瓨鐓曢柣妯虹枃婢规﹢鏌嶇紒妯诲碍閾伙絽鈹戦崒婵囶棄缂傚秴锕獮鍐敂閸繄鍔﹀銈嗗笒鐎氼剟宕归崒鐐村仯閺夌偞濯介鐔哥箾閸忚偐澧紒缁樼☉椤斿繘顢欓懡銈囨晨闁诲海鎳撻幉锛勬崲閸岀偛鐓橀柟杈鹃檮閸嬫劙鏌涘▎蹇fЧ鐎规洘濞婂娲川婵犲啰鍙嗛梺缁樼墱閸樠囷綖韫囨拋娲敂閸曨偆鐛╁┑鐘垫暩婵娊鎳楅崜浣瑰床濞撴埃鍋撴慨濠冩そ瀹曨偊濡烽妷鎰剁稻閵囧嫰濡搁妷锕€娈楅梺绯曟杺閸ㄤ粙鐛鈧鍫曞箣椤撶偞顔撻梻浣筋嚙鐎涒晝绮欓幒鏇炵稊闂備礁缍婇弨鍗烆渻閽樺娼栭柧蹇撴贡绾惧吋淇婇婵愬殭缁炬澘绉归弻锝嗘償閵忊懇鏋旈梺鍝勬噽婵炩偓闁绘侗鍠楀鍕箛椤掑偆鍟囧┑鐐舵彧缁茶棄锕㈤柆宥呭偍闁告稑锕︾粻楣冨级閸繂鈷旈柛鎺嶅嵆閺岀喓鎷犺缁♀偓濡ょ姷鍋涢ˇ闈涚暦椤愶箑唯鐟滃繘鏁嶅⿰鍐炬富闁靛牆妫欓悡銉ヮ熆瑜忛弲顐﹀极椤斿皷妲堥柕蹇ョ磿閸橆亪姊洪崜鎻掍航闁告挻绋撶划鏃堫敊闁款垰浜鹃悷娆忓缁€鍐煥閺囨ê鐏茬€规洘妞介弫鎾绘偐閼碱剦妲伴梻渚€娼ф灙闁稿孩濞婇幃鍧楀礋椤掑倻鐦堥梺姹囧灲濞佳冩毄闂備浇妗ㄩ悞锕傚箖閸屾氨鏆﹂柟杈鹃檮閸婄兘鏌涘┑鍡楊仼闁诲寒鍙冨濠氬磼濮樺崬顤€缂備礁顑嗛幑鍥ь嚕閹惰姤鏅滃┑顔藉姃缁ㄥ姊洪崷顓炲妺闁搞劎鏁婚、鏃堝煛閸涱喚鍘遍梺鐟邦嚟婵挳鍩㈤崼銉︾厸閻忕偟鍋撶粈瀣偓瑙勬礈閸樠囧煘閹达箑绠涙い鎾筹紡閸ャ劉鎷虹紓鍌欑劍钃遍悘蹇庡嵆閺岋綁鎮㈤崣澶嬬彋閻庢鍠涢褔鍩ユ径鎰潊闁绘ḿ鏁搁弶鍛婁繆閻愵亜鈧牕顔忔繝姘;闁规儳澧庣壕濂告煟濞嗘劗鎳冩繛璇х畵閹繝寮撮姀锛勫弳濠电娀娼уΛ娆愬緞閸曨剛绠鹃柛娑卞枟缁€鍫㈢磼鏉堛劌绗氭繛鐓庣箻婵℃悂濡疯閹虫牗绻濋悽闈涗户闁告鍛床婵☆垵顔婄换鍡涙煙闂傚顦﹂崬顖炴偡濠婂啰绠绘鐐诧躬瀵粙濡歌閻﹀牓姊哄Ч鍥х伈婵炰匠鍕浄鐟滄棃寮诲☉妯滅喖鎮╅崣澶婃閻庤娲栧鑸电┍婵犲浂鏁嶆繝鍨姇閺佺晫绱撴担绛嬪殭婵☆偅绻堝濠氭偄閸忓皷鎷婚柣搴ㄦ涧婢瑰﹤危椤曗偓閺屾盯鎮滈崱妤冧桓闂佽鍠栭崲鏌ャ偑娴兼潙绀冩い蹇撴-閸熷淇婇妶鍥ラ柛瀣洴閺佸啴顢旈崟闈涙婵炲濮撮鍛劔闁荤喐绮岀换姗€骞嗘笟鈧畷濂稿Ψ閿旇瀚兼繝娈垮枤閹虫挸煤閵堝鍊堕柛娆忣槺缁犳儳霉閿濆懎鏆遍悗姘煎櫍閵嗗懏顦版惔銏犳瀾闂佸搫鍟悧鍡涙嫅閻斿摜绠鹃柟瀵稿剱閻掓悂鏌i弬鍨倯闁稿鍔欓弻娑樷枎韫囷絾笑濠电偛鎳岄崐婵嬪箖濡ゅ啯鍠嗛柛鏇ㄥ墰椤︺儵鎮楀▓鍨灕闁糕晜鐗滅划姘綇閵娧呯槇闂佹悶鍎撮崺鏍疾椤掆偓閳规垿鎮╅懠顑跨驳闂佸憡姊瑰ú鐔奉嚕椤愶附鍋╃€光偓閳ь剛澹曢挊澹濆綊鏁愰崶鈺傛啒闂佹悶鍊栭悷锔界┍婵犲浂鏁冮柨婵嗘处閸f澘螖閻橀潧浠滈柣妤佹尰娣囧﹪骞栨担鑲濄劑鏌曡箛濠傚⒉闁哄鎮傚缁樻媴閾忓箍鈧﹪鏌涢幘瀵哥疄闁诡喚鏌夐ˇ鍦偓瑙勬礃缁诲嫮鍒掑▎鎰劅闁规儳鐡ㄩ弶鎼佹⒒娴h鐏遍柡鍛洴瀹曨垱瀵奸弶鎴犵厬闂侀€炲苯澧扮紒杈ㄦ尰閹峰懘宕崟鎴秮閺岋絽螖娴e湱顦伴梺鎸庣箘閸嬬姷绮诲☉妯锋婵炲棗绻嗛崑鎾剁磼濡湱绠氬銈嗙墬閻熴劑顢楅悢鍏肩厱闁靛牆鍟埀顒佹礋閸╃偤骞嬮敂钘夆偓鐑芥煕濞嗗浚妯堟俊顐節濮婃椽骞栭悙鎻掝瀷闂佽桨娴囬褔鎮鹃悜钘変紶闁告洦鍘藉▓鏇㈡⒑閸涘﹥澶勯柛蹇旓耿楠炲繐煤椤忓應鎷婚梺绋挎湰濮樸劍鏅跺☉姘辩<閻庯綆鍋呯亸浼存煛閸涱厾鍩e┑顔瑰亾闂侀潧鐗嗛幊搴ㄥ吹閹存繍娓婚柕鍫濇噽缁犱即鏌熼崘鍙夋拱缂佸倸绉撮オ浼村礋閳衡偓缁ㄥ姊虹憴鍕棎闁哄懏鐩幃姗€顢欓崜褏锛滈梺缁樏壕顓㈠矗閳ь剟姊洪崫鍕拱婵炶尙鍠庨悾閿嬬附閸撳弶鏅㈤梺閫炲苯澧撮柕鍡楁嚇椤㈡宕熼鍌氬箥闂備礁鎲¢悷銉┧囬挊澶嗘灁婵犲﹤鍟犻弨浠嬫煃閵夈儳锛嶉柛鈺嬬悼閳ь剝顫夊ú婊堝窗閺嶎厹鈧礁螖閸涱厾锛滃┑鐐村灦濮樸劑鍩㈡径鎰拻闁稿本鑹鹃埀顒佹倐瀹曟劙骞栨担鍝ワ紮婵$偛顑呭ù鐑芥儗閸℃褰掓晲婢跺姘﹂梺鍏兼緲濞尖€愁潖濞差亶鏁嗛柍褜鍓涚划鏃傗偓鐢登归ˉ姘舵煕瑜庨〃鍡涙偂韫囨稒鐓曟い鎰剁悼缁犳牕顭跨捄鍝勵伀闁逞屽墲椤煤濮椻偓閹繝鏁撻悩鑼舵憰濠电偞鍨崹鍦不濞戙垺鈷掗柛顐ゅ枔閳洘绻涢崼鐔烘噭缂佺粯绻堟慨鈧柨婵嗘噽閸橆偊姊洪崨濠冣拹婵炶尙鍠庨悾宄邦潨閳ь剟宕洪埀顒併亜閹烘垵顏柍閿嬪灴濮婂宕奸悢鎯板悅濠电偞鍨崹鐟邦啅濠靛洢浜滈柡宥冨妺缁惰鲸绻涢崗鍏煎磳婵﹤顭峰畷鎺戭潩椤戣棄浜鹃柣鎴eГ閸婂潡鏌ㄩ弴鐐测偓褰掑磿閹寸姵鍠愰柣妤€鐗嗙粭鎺楁煕閵娿儱鈧潡寮婚敃鈧灒濞撴凹鍨卞皬缂傚倸鍊搁崐鐟邦潩閵娾晛绠熼柛娑橈攻閸庣喖鏌ㄥ┑鍡樺窛闁绘帒娼¢幃妤呯嵁閸喖濮庨梺缁橆殔鐎氼厾绮嬪鍫涗汗闁圭儤鎸鹃崢鐢告⒑缂佹ê鐏﹂拑閬嶆倶韫囨洘鏆柡灞剧☉椤粓鍩€椤掍胶顩查柛顐f礀閽冪喖鏌ㄥ┑鍡橆棡闁稿海鍠愰妵鍕冀閵娧呯厒闁哄稄绻濆缁樻媴閸涢潧缍婇、鏍川閺夋垹鐤囬梺褰掑亰閸橀箖銆呴弻銉︾厵闂傚倸顕ˇ锔剧磼閻橆喖鍔滈柕鍥у瀵剟宕归瑙勫瘱闂備焦瀵х粙鎺斿垝鎼达絾顫曢柟鎹愵嚙绾惧吋绻涢崱妯虹仴濠碉紕鏅埀顒€鍘滈崑鎾绘煥濠靛棛澧涚痪顓炲缁辨帡顢欏▎鎯ф濡炪値鍋呯划鎾诲春閳ь剚銇勯幒鎴濐仼闁藉啰鍠愮换娑㈠箣濞嗗繒浠鹃梺绋款儐閸旀瑩骞冭ぐ鎺戠倞闁搞儜鍐句痪闂佸搫妫旈崡鎶藉蓟閿濆棙鍎熼柨娑樺缁潧鈹戦悩顔肩仾瀹€锝呮健閸┾偓妞ゆ帊绀侀崵顒勬煕閹捐泛鏋涙鐐插暣楠炲棜顦柡鈧禒瀣€甸柨婵嗙凹缁ㄤ粙鏌涢弮鎾剁暠妞ゎ亜鍟存俊鍫曞幢濡ゅ啰鎳嗛梺璇插閸戝綊宕i崘顭戝殨闁哄被鍎洪弫鍡涙煕閺囥劌澧伴柛妯圭矙濮婃椽宕崟顐熷亾閹间焦鍊舵繝闈涱儏缁犳牠鏌熸潏楣冩闁绘挸鍟村娲垂椤曞懎鍓伴梺璇茬箚閺呮繄妲愰幒鎾寸秶闁靛ǹ鍎抽鍌炴⒑闁偛鑻晶鍓х磽瀹ュ懏顥㈢€规洏鍨介幃鍓т沪閹冨箲闂備礁鎲¢幐鐑芥嚄閸撲礁顥氬┑鍌氭啞閻撶喐淇婇婵囶仩闁挎稑绉归弻娑樷枎鐏炴垝澹曢梻鍌氬€风粈渚€骞栭銈嗗仏妞ゆ劧绠戠粈澶愭煙鐎涙ḿ绠ラ柛銈嗘礋閺屸剝寰勭€n亝顔曢梺缁樻煥閸氬骞嗛悙鐑樷拺妞ゆ劧绲块埊鏇㈡煕鐎n亝鍣归柍瑙勫灴閺佸秹宕熼鈩冩線闂備胶枪閿曘儵鎮ч弴鐘插疾闂備礁鍟块幖顐﹀疮閹殿喚鐭嗗┑鐘插€堕埀顒佸笒椤繈鏁愰崨顒€顥氶梻鍌欑窔濞佳兾涢弮鍌涱偨婵﹩鍓﹂崵鏇㈡煙缂併垹鏋涙い顐㈡嚇閺屽秹鍩℃担鍛婃闂佺粯绻冮悧鐘差潖缂佹ḿ鐟归柍褜鍓熼崺鈧い鎺戝€告禒婊堟煠濞茶鐏¢柡鍛埣瀵泛鈻庨崜褍鏁搁梺鑽ゅ枑閻熴儳鈧凹鍘剧划鍫ュ礃椤忓棛锛滈柡澶屽仦婢瑰棝鎯屽▎鎴斿亾鐟欏嫭纾搁柛鏂跨Ф閹广垹鈹戠€n亞顦板銈嗗姂閸ㄥ顢欓幋锔解拻闁稿本鑹鹃埀顒勵棑缁牊鎷呴搹鍦槸婵犵數濮村ú銈囧鐠囨祴鏀介柣妯哄级閹兼劙鏌涚仦璇插闁哄矉缍侀弫鎰板川椤栨粈绱樼紓鍌欒閸嬫挸鈹戦悩鍙夊闁绘挻鐟╅幃妤€鈽夊▎瀣窗闁荤姵鍔忛弲婵嬪箟閹间焦鍋嬮柛顐g箘閻熸煡姊虹粙娆惧剱闁告梹鐟╅獮鍐潨閳ь剟骞冨▎鎾崇闁瑰搫妫楁禍楣冩煕濞戞﹫鍔熸い鈺呮敱閵囧嫰寮村Δ鈧禍鎯р攽椤旂》鏀绘俊鐐舵閻g兘顢曢敃鈧粈瀣亜閹捐泛孝濠殿喚鏅槐鎾诲磼濮橆兘鍋撻崫銉х煋妞ゆ洍鍋撶€规洘鍨块獮姗€宕滄担鐚寸闯濠电偠鎻徊浠嬪箹椤愶絿澧¢梻鍌欒兌閸庣敻寮查埡鍛瀭濞村吋鎯岄弫瀣煥濠靛棭妲哥紒鐘电帛閵囧嫰寮崶顭戞闂侀€炲苯澧伴柛蹇旓耿瀵鏁愰崨鍌涙閸┾偓妞ゆ帒瀚崑瀣煕閳╁啰鈯曢柛瀣€块弻锟犲炊閵夈儳浠鹃梺鎶芥敱鐢帡婀侀梺鎸庣箓閹冲繘宕悙鐑樼厵妞ゆ牗姘ㄦ晶娑㈡煏閸パ冾伃妤犵偛顑夐幃娆撳箵閹烘繃缍岀紓鍌氬€风粈渚€宕愰崫銉х煋闁圭虎鍠撻崑鎴澝归崗鍏肩稇闂佸崬娲弻锝夊籍閸ヮ煈浠╅梺鍝勬閸ㄨ櫣鎹㈠┑瀣仺闂傚牊鍒€閵夆晜鐓涘ù锝呮啞閸熺偤鏌熸笟鍨妤犵偞锕㈤、娆撴嚍閵夛妇褰囬梻鍌欑窔濞佳囨偋閸℃蛋鍥敍濠婂懍绗夐梺缁樓归褏绮荤憴鍕闁挎繂楠告晶顕€鏌h箛锝呮灍闁靛洤瀚伴崺锟犲磼濮樿京銈烽梺鍓х帛閻楃娀寮婚妸銉㈡斀闁糕剝锚濞咃綁姊洪崫鍕棤闁稿鍊濆濠氭晲婢跺﹦顔掗悗瑙勬礀濞层劑顢欓幒妤佲拺闁告繂瀚﹢浼存煟閳哄﹤鐏″ǎ鍥э躬閹粓鎸婃径宀婂悈婵犵數濞€濞佳兾涘▎鎾村€堕柟鎯ь嚟缁犻箖鎮楅悽鐧诲湱鏁崼鏇熺厱闁绘柨鎲$亸锔筋殽閻愭彃鏆欓摶鏍煃瑜滈崜鐔煎春閵忋倕绠婚悹鍥ㄥ絻閻庮厼顪冮妶鍡樷拻闁哄拋鍋呯粋宥夋嚋閻㈢數鐦堥梺姹囧灲濞佳勭濠婂牊鐓曟慨姗嗗墻閸庢棃鏌熼鎯у幋濠碘剝鎮傞崺锟犲磼濮橈絽浜鹃柛顐f礃閻撴洟鏌熸导瀛樻锭闁哄鍠栭弻宥夋煥鐎n亞浼屽┑顔硷攻濡炰粙銆侀弴銏犖ч柛娑卞墰閹规洟姊绘担绋挎倯婵$偛娼″畷褰掓焼瀹ュ懐鏌ч梺鍓插亝濞诧箓寮鍡欑瘈濠电姴鍊归崳浠嬫煥濞戞瑧鐭掓慨濠呮缁瑩骞愭惔銏″婵犳鍠楄彠闁告柨绉归幃褎鎯旈妸锔规嫽婵炴挻鍩冮崑鎾寸箾娴e啿娲﹂崑瀣煟閹邦喗鏆╃紒鈧繝鍋綊鏁愰崨顔藉枑闂佸搫妫撮梽鍕箞閵娿儺娓婚悹鍥紦婢规洟姊绘担铏广€婇柡鍛箞瀹曟垿濡舵径濠勭暫濠电偛妫欓幖鈺呭极閸℃稒鐓冪憸婊堝礈閻旂鈧線寮崶銉ゆ睏闂佸湱鍎ら幐鎾箯缂佹ḿ绠鹃弶鍫濆⒔缁夘剚淇婇銏狀伃鐎规洏鍎甸幃鐑藉箥閾忣偅鏉告俊鐐€栧Λ浣规叏閵堝洨绀婇柟杈鹃檮閸嬪倿鏌曢崼婵愭Ч闁绘挾鍠愭穱濠囶敍濞戝崬鍔岄梺鎼炲€栭悷鈺呭蓟閿濆绠抽柟瀵稿С缁敻姊洪棃娑欐悙閻庢矮鍗抽悰顕€骞掑Δ鈧粻锝嗙節闂堟稒澶勬い鏂款樀濮婄粯鎷呴搹鐟扮缂備浇顕х粔鐢电矉瀹ュ鏁傞柛顐g箚閹芥洟姊洪幐搴g畵闁绘绻橀幃鍧楀焵椤掑嫭鈷戦悷娆忓缁€鍐╃箾婢跺娲撮柛鈺佹嚇濡啫鈽夐幒鎾存澑婵$偑鍊栧濠氬Υ鐎n喖缁╃紓浣姑肩换鍡涙煟閹邦厼顥嬮柣顓熺懇閺岋絽鈽夐崡鐐寸彎閻庢鍠曠划娆撱€佸鈧幃銏焊娴i晲澹曢梺缁樺灱婵倝鎮¢悩鐢垫/闁哄鐏濋懜褰掓煕濡粯鍊愰柡宀嬬秮婵$兘顢欐繝姘粣婵犳鍠栭敃锔惧垝椤栫偛绠柛娑樼摠閹偤鏌i悢绋款棆妞ゆ劕銈稿缁樻媴閸涘﹨纭€闂佸啿鍢查悧鎾崇暦閹达箑骞㈡繛鎴炨缚椤斿姊洪棃娑氱濠殿噮鍙冨銊︾鐎n偆鍘遍梺鏂ユ櫅閸熶即骞婇崟顒傜闁割偆鍠庨崝銈夋煃鐟欏嫬鐏撮柟顔界懇瀹曪絾寰勯崱妯间簽婵犵數鍋涢悺銊у垝瀹ュ洤鍨濋柟鍓х帛閺呮煡鏌i幇顒佹儓鐎瑰憡绻堥幃妤€鈽夊▎瀣窗闂佸憡蓱閹瑰洤顫忛搹鍏夊亾閸︻厼校闁靛棗鍟扮槐鎺楀焵椤掍胶鐟归柍褜鍓欓锝夊礃濞村鐎婚梺瑙勫劤椤曨參宕㈤柆宥嗏拺闁告繂瀚埀顒€婀遍埀顒傜懗閸パ冩優闂佹悶鍎崝宥夊矗韫囨挴鏀介柣妯诲絻閺嗙偤鏌曢崶銊х畺濞e洤锕、鏇㈠閻樿櫕顔勯梻浣哥枃濡嫰藝椤栫儑缍栨繝闈涱儛閺佸棗顭跨捄渚剱闁伙附甯楃换婵嬫偨闂堟刀銉╂煛娴h鍊愮€规洘鍨甸埥澶愬閳ュ啿澹嬪┑鐐存綑閸氬岣垮▎鎴犵焼濠㈣埖鍔栭悡娆撴倵濞戞瑡缂氱紒鐘劦閺屾盯濡堕崱妯碱槹闂佸搫鏈惄顖炪€侀弴銏℃櫜闁糕剝鐟Σ顒傜磽閸屾瑨鍏屽┑顔惧厴楠炲﹪骞樼紒妯肩暢闂傚倷鐒︾€笛呮崲閸岀偛绠犻幖杈剧稻閺嗘粓鏌曟繛鐐珕闁绘挻鐟╁娲垂椤曞懎鍓遍梺闈涙处缁诲啴骞堥妸锔剧瘈闁告劏鏂傛禒銏犫攽閳藉棗浜滈柛鐔告尦瀹曟椽鍩勯崘鈺侇€撻梺缁樺灦椤嫰骞掑Δ浣叉嫽婵炶揪绲介幉锟犲疮閻愮儤鐓熼柣鏃€娼欓悘鑼偓瑙勬礃閸ㄥ潡鐛鈧顒勫Ψ閿旇姤婢戦梻鍌欑劍鐎笛呯矙閹寸姭鍋撳鐓庡缂佸倸绉甸妶锝夊礃閳哄啫骞嶆俊鐐€栧濠氬储瑜旈崺鈧い鎺嗗亾闁诲繑绻堥、姘舵晲閸ャ劌鐝板┑鐐存綑椤戝棝锝炲澶嬧拺闂傚牊绋撶粻鍐测攽椤旇偐澧﹂柛鈺嬬節瀹曟﹢鍩℃担鍦偓楣冩煟鎼达紕鐣柛搴ㄤ憾钘濇い鎾卞灩閻掑灚銇勯幒鍡椾壕闂佺ǹ锕ゅḿ锟犵嵁婵犲洤鍐€妞ゆ挾鍋熼崢鎼佹⒑閸涘﹤濮﹀ù婊堫棑濡叉劙寮婚妷锔规嫽婵炶揪绲介幊娆掋亹閹烘垵鐝樺銈嗗坊閸嬫挻銇勯锝囩疄濠碘剝鎮傞弫鍌炴嚍閵壯冪稇婵犵數濮撮惀澶愬级鎼存挸浜炬俊銈勭劍閸欏繘鏌i幋锝嗩棄缁惧墽绮换娑㈠箣閻戝棛鍔┑鐐村灦鑿ら柛顐邯閺屾盯鍩¢崟顒傘€愬┑鐐叉▕閸欏啴濡存担鍓叉僵閻犻缚娅i崝锕€顪冮妶鍡楃瑨閻庢凹鍓熼幏鎴︽偄閸忚偐鍙嗛梺缁樻煥閹碱偄鐡梻浣虹帛鐢帡鎮樺璺何﹂柛鏇ㄥ灠缁犲磭鈧箍鍎遍悧鍡涘储閳ユ剚娓婚柕鍫濆€瑰▍鍥煕韫囨棑鑰挎鐐插暙铻栭柛娑卞枟濞呮粓鏌熼懖鈺勊夐柍褜鍓濈亸娆撳极閺嶎厽鈷掑ù锝呮啞閸熺偤寮搁鍛箚妞ゆ劑鍨归顓㈡煕閳哄啫浠辨鐐差儔閺佸啴鍩€椤掑嫭鍋傞柨鐔哄У閻撴洟鏌嶉埡浣告灓婵炲牊锚闇夐柣妯挎珪缂嶆垿鏌嶇憴鍕伌闁诡喗鐟╁畷锝嗗緞婵犲嫬绲界紓鍌氬€搁崐鍝ョ矓瀹曞洨鐭嗗〒姘e亾妞ゃ垺宀搁弫鎰緞婵犲嫷鍟囧┑鐐舵彧缁蹭粙骞楀⿰鍩跺洭濡搁妷顔藉瘜闂侀潧鐗嗘鎼佺嵁濡ゅ懏鐓曢柕濞垮劤缁夎櫣鈧娲﹂崜鐔煎箖娴犲宸濆┑鐘插楠炴姊绘担铏瑰笡闁哄被鍔戦獮妤€饪伴崼婵堢枃闂佸憡鍔﹂崰妤呭磹閸偅鍙忔俊顖溓归崝姘舵煕閺傝鈧妲愰幒鎾寸秶闁靛⿵绠戠喊宥咁渻閵堝骸浜濈紒璇茬墦楠炲﹤饪伴崼鐔蜂缓闂傚倸鐗婄粙鎴犵不濞差亝鈷掗柛灞剧懅缁愭梹绻涙担鍐叉硽閸ャ劎顩烽悗锝庝簽閻涖儵姊洪崫鍕偍闁搞劍妞介幃鐐烘嚍閵夛絼绨婚梺鍝勭Р閸斿娆㈡潏銊х闁割偅绮庨惌娆撴煛瀹€瀣М妤犵偛娲、妤呭焵椤掑倻妫憸搴ㄥΦ閸曨垰唯闁靛繒濮撮埛澶愭⒑闂堟稒鎼愰悗姘煎灦钘濋弶鍫氭櫇绾惧ジ鏌ら幖浣规锭闁告繆娅i埀顒侇問閸犳牠鈥﹂悜钘夋瀬闁归偊鍘肩欢鐐测攽閻樻彃顏撮柛鐔奉儔濮婄粯鎷呴搹鐟扮闂佸憡姊归敋閾荤偤鏌涢弴銊ュ妞も晠鏀遍妵鍕即濡も偓娴滄儳鈹戦纭锋敾婵$偠妫勯悾鐑筋敃閿曗偓缁€瀣亜閹捐泛孝濠殿喚鏅槐鎾诲磼濞嗘劗銈版俊鐐差嚟鏋悡銈嗕繆椤栨繂浜归柣顓烆樀閺岀喖鎮滃鍡樼暦闂佸搫鎳忕划鎾诲蓟閿濆绠涢梻鍫熺☉椤晠姊虹紒妯肩畱闁告鍟块~蹇撁洪鍕祶濡炪倖鎸炬慨瀵哥箔閿熺姵鐓熼柕蹇婃櫅閻忔瑩鏌¢崨顖氣枅妤犵偛鍟灃闁告侗鍘鹃鍛存⒑閸忛棿鑸柛搴櫍楠炲繒绱掑Ο鑲╊啎闁哄鐗嗘晶浠嬪礆娴煎瓨鐓欓柤鎭掑劤閻帞鈧鍠楅幃鍌氱暦濮椻偓閸╃偞寰勯崫銉ф晨濠碉紕鍋戦崐鏍礉閹达箑鏄ラ柛鏇ㄥ€犻悢鐓庣劦妞ゆ帒瀚崐鐢告偡濞嗗繐顏紒鈧埀顒傜磽閸屾氨孝闁挎洏鍊濋幃楣冩偪椤栨ü姹楅梺鍦劋缁诲啴寮查埡鍛拺缂備焦锚婵箓鏌涢幘鏉戝摵妞ゃ垺鐟╁鎾閳锯偓閹风粯绻涙潏鍓у埌闁硅绻濆畷顖炴倷濞n兛绨婚梺闈浨归崕铏櫠閿旈敮鍋撶憴鍕婵炶尙鍠栭悰顕€宕堕澶嬫櫈闂佸吋绁撮弲婵堢玻濡ゅ懏鈷掑〒姘e亾婵炰匠鍡楊杺闂備礁鎼幊蹇曞垝閹捐绠栭柨鐔哄Т閸楁娊鏌曡箛銉х?闁告ɑ鎹囧铏光偓鍦У閵嗗啰绱掗埀顒佺瑹閳ь剙顕i幖浣规櫇闁稿本绋撻崢閬嶆椤愩垺绁紒鑼跺Г閺呭爼顢氶埀顒勫箺閸洖鍐€妞ゆ挾鍠撻崢钘夆攽閳藉棗鐏犻柣蹇旂箞閹啴鎼归崷顓狅紲闂佺粯锚瀹曨剙鐣甸崱娑欑厸閻忕偟鏅倴闂佺懓寮堕幐鍐茬暦閻旂⒈鏁冮柕鍫濆缁€澶愭⒒閸屾瑦绁版俊妞煎妿缁牊鎷呴搹鍦厠闂佽崵鍠愭竟鍡涘汲閿曞倹鐓熼柡鍐ㄥ€甸幏锟犳煛娴gǹ鏆i柡灞界Ч閸┾剝鎷呴崨濠冾唹缂傚倷娴囬崺鏍х暆缁嬫娼栧┑鐘宠壘绾惧吋绻涢崱妯虹瑨闁告﹫绻濋弻锛勨偓锝呭悁闁垶鏌$仦璇插鐎殿喗娼欒灒闁告繂瀚闂佽姘﹂~澶娒哄Ο鍏煎床闁稿瞼鍋涢悡婵嬪箹濞n剙鈧鎮块埀顒勬⒑閹稿海绠撻柟鍐茬箻椤㈡﹢宕稿Δ浣叉嫽婵炶揪绲介幉锛勬嫻閿涘嫮纾兼い鏇炴噹閻忕姵銇勯弬璺ㄧ缂佺粯绻傞~婵嬵敆閸屾碍鎲㈡繝鐢靛仜椤曨厽鎱ㄩ幘顕呮晞闁糕剝绋戠壕褰掓煟閵忕姵鍟為柣鎾卞劜缁绘繈妫冨☉娆樻¥闂佸憡鍨靛﹢杈╂閹烘惟闁靛ǹ鍎涢幘缁樼厪闁搞儜鍐句紓闂佺粯鏌х欢姘跺蓟濞戙垹绠涢柛鎾茶兌钃遍梻浣告惈閸婄敻宕戦幘鏂ユ斀闁挎稑瀚禍濂告煕婵犲啰澧电€殿喖顭锋俊鎼佸煛鐎n剛鈼ら梻浣告惈濞层劑宕伴幘姹団偓鍛存煥鐎n剛鐦堟繝鐢靛Т閸婄粯鏅跺☉銏$厽闁规儳鐡ㄧ粈瀣煙椤旂瓔娈滈柡浣瑰姈閹棃鍨鹃懠顒€鍤梻浣筋嚙缁绘劗鎹㈤幒妤€鏋佸┑鐘宠壘閽冪喓鈧箍鍎遍悧婊冾瀶閵娾晜鈷戦柛娑橈攻鐏忔壆鈧厜鍋撻柟闂撮檷閳ь兛绀侀埢搴ㄥ箻閸愭彃鏁ゆ俊鐐€栭幐楣冨磻閻斿吋鍋橀柕澶堝劗閺€浠嬫煟閹邦厽缍戦柣蹇曞枛閺屾盯鍩℃担鍓蹭純閻庢鍣崑鍡涘焵椤掑﹦绉甸柛鎾村哺瀹曚即骞囬悧鍫㈠幐闂佸憡鍔戦崝搴㈡櫠閺囥垺鐓涢柛鏇楁櫅閸旓箓鏌$仦鐐鐎垫澘瀚埥澶婎潩鏉堛劍顔忕紓鍌氬€风粈浣规櫠鎼淬劌纾绘繛鎴欏灩閻撴﹢鏌熸潏楣冩闁稿﹪鏀遍妵鍕疀閹炬剚浼€婵炲鍘х€氭澘顫忓ú顏勪紶闁靛鍎涢敐澶嬬厽婵°倕鍟瓭濡炪倖娲╃徊鍓ф崲濠靛棭娼╂い鎴旀杹閺呮繈骞夐崨濠傜窞闁归偊鍓涢敍娑㈡⒑閻熸澘鈷旂紒顕呭灦瀵煡寮婚妷锔惧幈濠电偞鍨靛畷顒勬倶閻旇櫣纾兼い鏃傚亾閺嗏晝绱掓潏銊﹀磳鐎规洘甯掗~婵喰掑▎宥呯伈闁哄矉缍侀、姗€鎮欏ù瀣壕闁归棿绶ょ紞鏍叓閸ャ劍鈷掔紒鈾€鍋撴繝娈垮枟閿曗晠宕滃☉銏℃櫖婵犲﹤鍟犻弨浠嬫煟閹邦剙绾фい銉у仱閺屾盯鍩℃担鍝勵暫闁告椴搁妵鍕即濡も偓娴滄儳鈹戦纭烽練婵炲拑绲介埥澶愭偨缁嬫寧銇濇繛杈剧到閹诧繝鎮块崒婊呯=闁稿本鐟ㄩ崗宀€绱掗鍛仯闁瑰箍鍨藉畷濂告偄閸撲胶鐣鹃梻浣告贡閾忓酣宕伴弽顐ょ焼闁告劏鏂傛禍婊堟煛閸屾繐楠忛柛瀣ㄥ灲閺屾盯鎮欓懠顒€鐓熷┑顔硷攻濡炶棄螞閸愩劉妲堥弶鍫涘壉閵堝鈷戠紒瀣仢椤掋垹鈹戦悙璇ц含鐎殿噮鍋勯濂稿川椤忓拋娼旀繝纰樻閸ㄥ爼寮ㄩ柆宥呮闁逞屽墴濮婄粯鎷呴搹鐟扮闂佸憡姊归悧鏇炵幓閸喒鏋庨柟鐐綑閳ь剙娼¢弻锝夊箛闂堟稑顫紓浣叉閸嬫挻淇婇悙顏勨偓銈夊磻閹烘鐭楅柍褜鍓熼弻娑滅疀閹惧墎浼囩紓浣介哺鐢岣胯箛娑樼厸濞达綁鏀遍~鏇㈡煟鎼淬埄鍟忛柛鐘虫礈閸掓帒鈻庨幘鎵佸亾娴e壊娼ㄩ柍褜鍓熼獮鍐閵堝懍绱堕梺鍛婃处閸嬪棝鎮烽弻銉︹拻闁稿本鑹鹃埀顒勵棑缁牊绗熼埀顒勭嵁婢舵劖鏅柛鏇ㄥ墮鎼村﹪姊虹粙鎸庢拱濠㈣娲熷畷鎴﹀箻閹颁焦鍍甸梺缁樻尭妤犲摜鐚惧澶嬪€甸悷娆忓缁€鈧梺鍝ュ枙濞夋洟宕i崨顓ф富闁靛牆鎳愮粻浼存煙閾忣偄濮嶇€规洏鍨介獮妯肩磼濡攱瀚藉┑鐐舵彧缁蹭粙骞楀⿰鍕浄闁靛緵棰佺盎闂佺懓鐡ㄧ换鍐吹閸ヮ剚鐓欐い鏃傜波缂傛岸鏌嶈閸撴盯寮崫銉﹀厹闁割偅娲栫壕濠氭煙閻愵剚鐏遍柡瀣閺屾盯鈥﹂幋婵囩亶闂佽绻愰悧鎾愁潖閾忓湱纾兼俊顖滃帶閳綊姊洪棃娑氬闁诡喖鍊块幃浼搭敋閳ь剙鐣峰鈧俊鎼佸閿涘嫧鍋撴繝姘拺閻熸瑥瀚崝銈囩棯缂併垹骞楁い銊e劦瀹曞爼顢楁担鍙夊闂佽崵鍠愰悷銉р偓姘煎弮瀹曟洖螖閸涱喚鍘卞┑鈽嗗灣缁垶宕愰幇顔瑰亾鐟欏嫭绀冮柛銊ユ健閻涱喖顫滈埀顒€顕i鍕ㄩ柕澹喚娼介梻鍌氬€风粈渚€骞夐垾瓒佸搫顓兼径濠勬煣濠电偛妫欓崹鍏兼叏閸愭祴鏀介柣妯虹-椤f煡鏌嶉柨瀣伌闁哄本绋戦埞鎴﹀幢濡ゅ﹣鎮i梻渚€鈧偛鑻晶顔剧磽瀹ュ拑韬柕鍡曠窔瀵€燁槷闁哄娴烽埀顒傛暬閸嬪﹪宕戦崱娑樼獥闁哄稁鍘奸弰銉╂煃瑜滈崜姘跺Φ閸曨垰绠抽柟瀛樼箥娴犻箖姊洪幎鑺ユ暠闁搞劌娼″璇测槈濡攱鏂€闂佺硶鍓濋〃蹇斿閳ь剟姊绘担铏瑰笡閻㈩垳鍠庨埢鏃堝即閻樻剚娼熼梺鍦劋濮婅崵澹曢崗闂寸箚妞ゆ牗绻傛禍褰掓煟閿濆洦鏆慨濠勫劋鐎电厧鈻庨幋鐐蹭还闂備胶枪缁绘垼鎽繛锝呮搐閿曨亪鐛弽銊﹀闁告縿鍎遍獮鎰攽閻樺灚鏆╁┑顔芥尦瀹曨垶顢涘锝嗙€洪梺鍝勭Р閸斿海寮ч埀顒€鈹戦悙鑼闁诲繑绻堝鎼佹偄閸忚偐鍙嗛梺鍝勬储閸斿本绂嶉悙纰樺亾閸偅绶查柨鏇樺劦婵″爼鏁愭径濠勵槰闂佸疇妗ㄧ拋鏌ュ磻閹剧粯鍋ㄩ柛娑橈功閸樿棄鈹戞幊閸婃劙宕戦幘缁樼厽婵°倐鍋撻柟铏姍楠炴垿濮€閵堝懎鑰垮┑鐐村灦閻熝囧储椤忓牊鈷戦柛鎾村絻娴滄繄绱掔拠鎻掓殻妤犵偞鐗犻獮鍥级鐠恒劍鐒鹃梻浣哥秺濡潡鎮為敃鍌氱厱闁瑰濮风壕濂告倵閿濆骸浜介柛搴涘劦閺屾稒鎯旈姀鐘差潚闂佸搫鐭夌紞渚€宕洪埄鍐瘈闁稿本绮堥崫妤呮⒒娴i涓茬紒鎻掓健瀹曟顫滈埀顒勫Υ娴g硶妲堟俊顖炴敱椤秴鈹戦绛嬫當婵☆偅顨呴埢鎾寸附閸涘ň鎷绘繛杈剧到閹诧繝骞嗛崼鐔翠簻闁挎柨鐏濆畵鍡欌偓瑙勬礈椤㈠﹪濡甸幇鏉跨婵犻潧娲﹀▍鎾斥攽閻橆喖鐏遍柛鈺傜墵瀹曟繈寮介鐐靛幈闂佺鎻梽鍕偂閺囩喓绠鹃柟瀵稿剳閸忣剟鏌¢埀顒傛嫚瀹割喚鍞甸柣鐘叉惈閹碱偊顢旈銏$厸閻忕偛澧介埥澶愭懚閿濆鐓曢柨鏃囶嚙楠炴﹢鏌i幘瀛樺磳闁诡喗顨堥幉鎾礋椤掑偆妲伴梻浣规偠閸斿酣寮繝姘櫜闁绘劖绁撮崼顏堟煕椤愶絿绠橀柛鏃撶畱椤啴濡堕崱妤冪懆闁诲孩鍑归崜鐔煎箯閹达附鍋勯悶娑掆偓鍏呭濡ょ姷鍋涢悘婵嬪礉濮橆厹浜滈柨鏃囶嚙閻忥箓鏌熼鍏夊亾閺傘儲顫嶅┑鈽嗗灠缁绘劗绱炴繝鍥ф瀬闁圭増婢樺婵囥亜閺傚灝鎮戞繛鍫燂耿濮婄粯鎷呯粵瀣缂備胶绮崹鍧楃嵁閹版澘绠瑰ù锝呮憸閸樻挳姊虹涵鍛涧闂傚嫬瀚板畷鎰版倻閼恒儳鍘电紓鍌欑劍閿氱紒妤佸哺閺屾稒绻濇惔锛勪哗闂佸疇顫夐崹鍧楀春閵夆晛骞㈡俊鐐插⒔閻╁酣姊绘担鍛婃喐闁革絻鍎靛畷鎴炵節閸ャ劍娅滈梺缁樺姇婢у酣鎮块埀顒勬⒑閸濆嫭宸濆┑顔惧厴閺佸秴饪伴崘锝嗘杸闂佸疇妫勫Λ妤呮倶閵夛负浜滈柡鍥ф濞村倿寮笟鈧弻鐔煎礈瑜忕敮娑㈡煃闁垮鐏撮柡灞剧☉閳藉顫滈崼婵嗩潬闂備礁鐤囧Λ鍕囬悽绋胯摕闁靛ň鏅涢崡铏繆椤栨碍鎯堝┑顕嗙畵閹鎲撮崟顒傤槰濠电偠灏欓崰鏍偘椤斿槈鐔兼嚃閳哄喛绱叉繝纰樻閸ㄦ娊宕㈣閻涱喖螖閸涱喒鎷绘繛杈剧秬濞咃絿鏁☉銏$叆婵ɑ澧庨崑鎾斥枔閸喗鐏曞┑鐐差槹閻╊垶銆佸▎鎺旂杸闁圭虎鍨遍弬鈧梺璇插嚱缂嶅棝宕戦崱娑樺偍闂侇剙绉甸悡鐔煎箹閹碱厼鐏g紒浣哄厴閺屾盯寮捄銊у姱闂佺硶鏂侀崑鎾愁渻閵堝棗绗傞柣鎺炲缁牏鈧綆鍠楅悡娆愩亜閺冨洦顥夐柛鏂诲€濋弻锝夋晲韫囨洜鐦堥梺鍝勮嫰濞差參寮崒鐐村癄濠㈣泛鐬兼径鍕⒒閸屾艾鈧娆㈠璺虹劦妞ゆ帒鍊告禒婊堟煠濞茶鐏¢柡鍛埣椤㈡岸鍩€椤掑嫬钃熼柨婵嗩槹閺呮煡鏌涘☉鍗炲箺娴滄稒淇婇妶鍡╂濞存粍鐟╁畷锟犲礃閼碱剚娈鹃梻渚囧墮缁夋挳鎮″☉銏$厱閻忕偠妫勯埀顒€鐖煎畷鏇㈡濞戣鲸缍庣紓鍌欑劍钃卞┑顖涙尦閺屾稑鈽夐姀鈩冮敪缂傚倸绉撮敃顏堝Υ娓氣偓瀵粙顢橀悙鑼垛偓鍨攽閻愭潙鐏﹀畝锝呮健椤㈡瑩宕堕浣哄幗闂佺粯锚瀵爼骞栭幇鐗堢厱闁绘劕鐏氬▍鏇犵磼鏉堛劍灏い顐g箞瀹曟粍鎷呯粙璺ㄥ闂傚倷鐒﹂幃鍫曞磿椤栫偛绀夐幖娣妼閻撯€愁熆閼搁潧濮堥柣鎾跺枛閺岀喖骞嗚閸ょ喐绻涢崣澶嬪唉闁哄矉绱曟禒锕傚礈瑜庨崚娑樜旈悩闈涗粶婵炲樊鍘奸悾宄拔旈崨顓炵獩婵犵數濮撮崐鐢稿磻閹剧粯鏅查柛銉㈡櫇閿涙繃绻涙潏鍓у缂侇喗鐟╁畷顐﹀传閸曘劍鏂€闂佺粯鍔橀婊冾啅閵夛负浜滄い鎰╁灮缁犲磭绱掓潏銊ョ瑨閾伙綁鎮归崶褎鈻曢柍褜鍓氶幑鍥ь潖濞差亜宸濆┑鐘插閸掓稑鈹戦悙鏉垮皟闁告侗鍨抽ˇ顖涚節閻㈤潧孝闁稿妫濆畷鐢稿即閵忥紕鍘介梺闈涚箳婵挳藟韫囨稒鐓涘ù锝呮啞椤ャ垽鏌$仦鍓ф创鐎殿喗鎸虫俊鎼佸Ψ閵夘喗浜ゅ┑鐘垫暩閸嬫盯鎮ц箛娑樼;闁绘劕顕埞宥呪攽閻樺弶鎼愰崶鎾椤愩垺澶勬繛鍙夌墵瀹曞搫鐣濋崟顑芥嫼闂佸憡绺块崕鍗炩枍韫囨稒鐓曢悗锝庝悍闊剚顨ラ悙鎻掓殻闁诡喗鐟╁畷顐﹀礋椤愩倐鍋撻鐑嗘富闁靛牆妫楁慨澶娾攽椤旇偐锛嶉柤楦块哺缁绘繂顫濋娑欏闂備浇宕甸崰鎾存櫠濡ゅ懎绠氶柛顐ゅ枍缁诲棙銇勯幇鍓佺У婵炲牊娲滅槐鎺楀磼濮樻瘷锝夋煏閸剛绉€规洘锕㈤崺鐐烘倷椤掆偓椤忓湱绱撻崒娆掑厡闁惧繐閰e畷銏$附缁嬭法鐤囬柟鍏肩暘閸娿倝寮虫潏鈺冪=闁稿本鑹鹃埀顒勵棑濞嗐垽鏁撻悩鑼崶闂佸搫绋侀崢浠嬫偂閳ь剟姊洪幐搴g畵闁硅櫕鍔欏鎶芥晜閼恒儱寮垮┑鈽嗗灡鐎笛呮兜閸撗呯<闁绘ḿ鍎ら悵顏勄庨崶褝韬┑鈥崇埣瀹曟帒顫濋銏╂缂傚倸鍊搁崐椋庢閿熺姴纾婚柛鏇ㄥ幘閻挾鎲搁悧鍫濈瑨闁藉啰鍠愮换娑㈠箣濞嗗繒鍔撮梺杞扮閸熸挳寮婚弴銏犻唶婵犻潧娲ゅ▍銈夋⒑缂佹ḿ濡囬柍褜鍓氶弸濂稿绩娴犲鐓冮柦妯侯槹椤ユ粌霉濠婂嫮鐭掗柡灞剧洴閹倖鎷呴梹鎰瀳闂備胶纭堕弲婵嬪磻閵堝宓侀悗锝庡枟閺呮粓鏌﹀Ο渚Т闁稿鎹囬弻銊р偓锝庡墰椤旀洟姊洪崜鎻掍簽闁哥姴閰i、姘堪閸曗晙绨婚梺闈涱檧闂勫嫮浜搁銏$厓閻熸瑥瀚悘鎾煙椤旂晫鎳囩€规洩绲惧鍕節閸愬彞鐢绘繝鐢靛Х閺佹悂宕戦悩鍏哥剨婵炲棙鎸哥粣妤呮煛瀹ュ骸骞樼€规挷绶氶弻娑㈠焺閸愵亖妲堢紓浣插亾閻庯綆鍋佹禍婊堟煛瀹ュ洦鏆╃紒瀣煼閺岋繝宕担绋款潻闂佸疇顫夐崹鍧椼€佸▎鎴炲枂闁圭儤娲﹀ḿ鎰版煏閸ャ劍鈷掔紒顔界懄閹棃骞樼€甸晲绨撮梻鍌欐祰椤曟牠宕规惔銊ョ劦妞ゆ帒瀚紒鈺呮煠閹帒鍔樺ù婊勭矒閺岋繝宕掑☉鍗炲妼濠电偠鍋愰崰搴ㄦ箒闂佺粯锚绾绢參鎯岄幒妤佺厸閻忕偛澧介妴鎺楁煃瑜滈崜銊х礊閸℃稑纾婚柛娑卞灟閻掑﹤霉閻撳海鎽犻柣鎾崇箻閺屾盯濡烽幋婵嗘灓濞寸厧鍟换婵嗏枔閸喗鐏€闂佺ǹ顑嗛幑鍥ь潖濞差亜绠伴幖杈剧岛濡插牓鏌f惔銏犲毈闁告瑥鍟悾鐑芥惞椤愩埄鍤ら柣搴㈢⊕鑿ら柟鐤缁辨帞绱掗姀鐘茬闂佺懓鍟跨换姗€骞冮悽鍓叉晜闁割偆鍠撻崢钘夆攽鎺抽崐鏇㈠疮椤愶箑鐓濋柛顐熸噰閸嬫挾鎲撮崟顒傤槰濠碉紕鍋樼划娆忣嚕椤愶箑绠荤紓浣姑禍褰掓⒑閼测斁鎷¢柛鎿勭畱鍗卞ù鐓庣摠閳锋帒霉閿濆毥褰掑汲闁秵鐓欑痪鏉垮船娴滄壆鈧娲﹂崹鍫曞箖閳哄啯瀚氶柤纰卞墾缁遍亶姊绘担鍛婅础闁稿鎸搁—鍐锤濡も偓閺嬩線鎮楅敐搴℃灍闁绘挸鍟伴幉绋库堪閸繄顦┑鐐叉閹碱偆绱為弽顓犲彄闁搞儯鍔嶉埛鎺旂磼閳锯偓閸嬫挻绻濆▓鍨灍闁挎洍鏅犲畷婊冣槈閵忊剝娅栧┑鐘诧工閸熺娀寮ㄦ禒瀣厽闁归偊鍓欑痪褎銇勯妷褍浠遍柡灞剧洴瀵噣鍩€椤掑嫨鈧啯绻濋崘褏绠氶梺鍓插亝濞叉牜鐥缁绘盯宕卞▎蹇庡闁诲酣娼ч惌鍌氼潖濞差亝顥堟繛鎴炶壘椤g儤淇婇妶鍥㈤柟璇х磿缁顓奸崨顏勭墯闂佸憡娲嶉弲娆戣姳婵犳碍鈷戦柟绋垮椤ュ棙銇勯弴鍡楁处閸婂爼鏌ㄩ弴鐐测偓褰掓偂濞嗘劑浜滈柡鍐ㄦ处椤ュ鏌涢弬璇测偓婵嬪蓟閿濆鏅查煫鍥ㄦ礈閻﹀牓姊洪崫鍕婵炲樊鍙冨顐﹀磼閻愭潙鐧勬繝銏f硾閻吋寰勯崟顖涒拻闁稿本鑹鹃埀顒勵棑濞嗐垹顫濈捄铏瑰姦濡炪倖甯掗崐鍛婄濠婂牊鐓犳繛鑼额嚙閻忥繝鏌¢崨顓犲煟妤犵偞锕㈤、娆撴偩鐏炶棄濡囬梻鍌欒兌绾爼宕滃┑鍠㈠搫饪伴崺璺烘喘閺佸倹鎱ㄩ幇顏嗙泿婵$偑鍊栭崝褏寰婄捄銊т笉闁绘劖鎯屽▓浠嬫煟閹邦剙绾у璺哄閺岀喎鐣¢悧鍫濇畻閻庤娲樼划鎾荤嵁閸ヮ剙惟闁挎梻鏅ぐ鍡椻攽閻戝洨鍒版繛灞傚€濋弫鍐敂閸繄鐣哄┑鐐叉閹尖晠寮崒鐐寸厱闁哄洦锚婵$厧霉濠婂牏鐣洪柡灞糕偓鎰佸悑閹肩补鈧磭顔愰梻浣芥閸熶即宕伴弽顓炶摕闁哄洨鍠撶粻鍓ф喐瀹ュ洠鍋撳鐓庡闁诡垱姊圭换婵嬪炊閵娿垺瀚奸梻渚€娼荤€靛矂宕㈡總鎼炩偓鍌炲礂閼测晝鐦堥梺闈涚箚濡插嫰鎳撻崸妤佺厵妞ゆ柨鍘滈崑鎾诲箛娴g懓缂撻梻渚€鈧偛鑻晶瀵糕偓娈垮枛椤兘骞冮姀銈呭窛濠电姴瀚倴闂傚倷绀侀幉锟犲箰閸℃稑宸濇い鏃傜摂閸熷懘姊婚崒姘偓鐑芥嚄閸撲礁鍨濇い鏍仜缁€澶愭煛閸ャ儱鐏柡鍛箖閵囧嫯绠涢幘璺侯暫闂佽棄鍟伴崰鏍蓟閿熺姴鐐婇柍杞扮劍閻庤崵绱撴担绋款暢闁稿鍊濆璇测槈閵忊晜鏅濋梺鎸庣箓濞层倝銆呴鍕拺缂佸顑欓崕鎰版煙閸涘﹦鎽冮柣蹇撳暣濮婃椽宕ㄦ繝浣虹箒闂佸摜濮甸悧鐘茬暦濠婂牜鏁嬮柍褜鍓熷濠氭偄閻撳海顦ч梺鍏肩ゴ閺呮粌鈻撻鍕拺闁告稑锕ラ悡銉х磼婢跺﹦绉虹€规洖鎼埥澶愬閻樻鍞洪梻浣告贡閸嬨劑宕濆畝鈧槐鐐寸節閸パ勭€梺鍦濠㈡ê顔忓┑鍥ヤ簻闁哄倸鐏濋幃鎴炵箾閸噦鑰挎慨濠勭帛閹峰懐绮电€n亝鐣伴梻浣规偠閸斿宕¢幎钘夌畺鐟滄棃鐛Ο鍏煎珰闁艰壈鍩栭幉鐗堢節閻㈤潧浠﹂柛顭戝灦瀹曠懓煤椤忓嫮锛涢梺绯曞墲椤﹂缚銇愰幒鎾存珳婵犮垼娉涢鍡涙偟瀹曞洨纾藉ù锝夋涧婵″吋銇勯鐘插幋鐎殿喖顭烽弫鎰緞婵犲嫷鍟嬮梻浣告啞椤ㄥ牓宕戦幇鏉跨;闁圭偓鏋奸弨浠嬫倵閿濆簼娴烽柟鑺ユ礋濮婃椽宕崟顒€鍋嶉梺鎼炲妼缂嶅﹪寮荤€n喖鐐婇柕濞у懐妲囬梻鍌氬€搁悧濠勭矙閹惧瓨娅犻柡鍥ュ灪閻撳啰鈧懓瀚竟鍡樻櫠閿旇姤鍙忓┑鐘插暞閵囨繄鈧娲﹂崑濠傜暦閻旂⒈鏁嗗璺侯儜缁辨绻濋悽闈涗粶闁宦板妿閸掓帟绠涢幘顖涚亙濠电偞鍩堝浣虹礊閺嶎厾鍙撻柛銉e妽缁€鍫㈢棯閹冩倯濞e洤锕、娑樷攽閹邦剚顔勬俊鐐€曠€涒晠骞愰崜褎顫曢柟鎯х摠婵挳鏌涢敂璇插箰婵℃彃鐗嗛—鍐Χ閸℃浠撮梺鐟板暱闁帮綁宕洪姀銈呯婵炶尙绮弲锝夋⒑闂堟盯鐛滅紒杈ㄦ礋瀹曘垺绂掔€n偆鍘甸梺绋跨箺閸嬫劙寮冲鈧弻娑㈠Ω閵夘喚鍚嬮梺绯曟杺閸ㄤ粙鐛Ο鑲╃<婵☆垳鍘ч獮鎰版⒒娴e憡鍟炲〒姘殜瀹曟澘顫濋懜闈涘壒閻庡厜鍋撻柍褜鍓涘Σ鎰板箳濡ゅ﹥鏅╅梺鑺ッˇ顖炲箺閻㈠憡鈷戦柛婵嗗鐎氱増淇婇锝庢疁妞ゃ垺蓱缁虹晫绮欓崹顔剧崺婵$偑鍊栫敮鎺楀磹婵犳艾纾归柣鎰劋閳锋帡鏌涚仦鍓ф噮妞わ讣绠撻弻鐔访圭€Q冧壕閻℃帊绶氱紓姘辩不濞戞ǚ妲堟俊顖溾拡濡茬兘鏌f惔锛勭暛闁稿酣浜惰棟濞村吋娼欑壕褰掓煕椤垵浜炵紒鐘插⒔閳ь剛鎳撴竟濠囧窗閺囩姾濮冲┑鍌氭啞閻撳啴姊洪崹顕呭剰闁诲繑鎸抽弻锛勪沪閸撗€妲堥梺瀹狀潐閸ㄥ灝鐣烽崡鐐嶆梹绻濇担鐑橈紡闂備浇顕уù鐑藉箠閹捐绠熼柨娑樺瀹曟煡鏌涘畝鈧崑娑㈡偂濮椻偓閺岀喐娼忛幆褏妲i梺杞扮椤戝寮诲鍫闂佸憡鎸婚悷銉╂偝婵犳碍鍤勬い鏍电稻閳诲矂姊绘担绛嬪殐闁革綇绲跨划濠氬冀椤撶偟鐣哄┑鐘诧工閻楀﹦鈧數濮撮…璺ㄦ崉閾忓湱浼囬梺鍛婏供閸撴瑩鍩為幋锔藉亹妞ゆ棁鍋愭导鍥р攽閻愬樊妲归柣鈺婂灦楠炲棙寰勭€n剟妾梺鍛婃尭瀵爼寮查埡鍛拺闁告繂瀚崒銊╂煕閵婏附銇濋柛鈺傜洴楠炲鏁傞悾灞藉箺闂備胶绮濠氬储瑜庣粋宥嗗鐎涙ḿ鍘遍梺闈涚墕濞层倝寮稿☉銏$厸閻忕偛澧介妴鎺楁煃瑜滈崜銊х礊閸℃稑纾婚柛鈩冾樅濞差亜绠绘い鏃傛櫕閸橀潧顪冮妶鍡樷拹闁稿氦娅曠粋鎺楀煛閸涱喚鍘梺鎼炲劘閸斿本鎱ㄥ鍡╂闁绘劖娼欏ù顔筋殽閻愮榿缂氶柟鐟板瀹曨偊宕熼鐘虫緰闂傚倸鍊搁崐宄懊归崶顒夋晪鐟滄柨鐣峰▎鎾村仼鐎光偓閳ь剛绮堟繝鍥ㄧ厱闁斥晛鍟伴埥澶岀棯閹岀吋闁哄本绋戦埥澶愬础閻愬吀鎴烽梻浣虹帛鐢帡鏁冮妷鈺佄﹂柛鏇ㄥ灠缁犲鏌涘Δ鍐ㄤ户濞寸娀绠栧铏圭磼濡纰嶉梺鍝ュ枑閹稿啿顕f繝姘櫇闁逞屽墲閻忔帗绻涢幘鏉戝毈闁搞劑浜堕崺銏ゅ箻閺傘儲鏂€闂佺偨鍎遍崯璺ㄧ棯瑜旈弻鐔碱敊閻撳簶鍋撻崹顕呭殨閻犲洤妯婇崥瀣煕閵夛絽濡奸柣婵呭嵆濮婃椽宕ㄦ繝鍕櫑濡炪倧闄勫姗€鎮鹃悜钘夌闁兼亽鍎幏娲⒒娓氬洤浜為柛瀣洴閹崇喖顢涘☉娆愮彿闂佸憡鎸嗛崨顖ょ闯闁诲骸绠嶉崕閬嶅箠韫囨蛋澶愬閳垛晛浜鹃悷娆忓缁€鍐磼椤旇偐鐒搁柛鈹垮劜瀵板嫭绻濇惔銏犲厞闂佸搫顦悧鍐疾濞戞氨涓嶉柛顭戝亞缁♀偓閻庡吀鍗抽弨鍗烆熆濮椻偓閸┾偓妞ゆ帊鐒︾粈瀣殽閻愯榫氱紒鐘崇☉閳藉螣閻撳骸绠為梻鍌欑濠€閬嶅磿閵堝鍚规慨妯煎仺娴滃綊鏌熼悜妯诲鞍婵炲懏绮撳娲礈閹绘帊鑸梺绋款儏閹虫劗妲愰悙鍝勯唶闁靛鑵归幏娲⒒閸屾氨澧涚紒瀣笒椤斿繐鈹戠€n偆鍘遍梺缁樏壕顓熸櫠閻㈢鍋撳▓鍨灕妞ゆ泦鍥х叀濠㈣泛谩閻斿皝鍫柛娑卞幗閻忓牆螖閻橀潧浠掔紒鑸靛哺閻涱噣骞掑Δ鈧粻锝嗙節婵犲倸鏆欓柣蹇擄攻缁绘繄鍠婃径宀€锛熼梺绋款儐閸ㄥ灝鐣烽幇鏉跨闁挎洍鍋撻柛銊ュ€圭换娑橆啅椤旇崵鍑归梺绋款儏椤戝寮婚敐鍛傜喖宕归鐐嚄闂備礁鎼Λ瀵哥不閹捐钃熼柡鍥╁枔缁犲墽鎲告径鎰;闁瑰墽绮悡鏇㈡倵閿濆骸浜濋悘蹇e弮閺屽秹鎸婃径妯恍﹂梺瀹狀嚙濞寸兘鍩€椤掑﹦绉甸柛鎾寸〒缁絽螖閸涱喒鎷绘繛杈剧秮椤ユ挻绋夐懠顒傜<闂婎偒鍘鹃惌娆戔偓瑙勬处閸ㄨ泛鐣风粙璇炬棃鍩€椤掑嫭鍋傛慨妞诲亾闁哄瞼鍠愬ḿ蹇斻偅閸愨晩鈧秹姊虹粙娆惧剱闁告梹鐟╁璇测槈閳垛斁鍋撻敃鍌氱婵犻潧鎳愰崙瑙勭節濞堝灝娅欑紒鑼櫕閳ь剚鍑归崢楣冨箲閵忕姭鏀介柛鈥崇箲閻忎線姊洪崜鑼帥闁哥姵顨婇幃姗€骞橀幇浣瑰瘜闂侀潧鐗嗛崯顐﹀礉濠婂牊鐓曢柡鍐e亾闁绘濮撮锝夋嚑椤掍礁纾柣鐐寸▓閸撴繈寮埀顒勬⒑鐠囨彃鍤辩紓宥呮瀹曟垿鍩€椤掑嫭鐓欓柣銈庡灡椤忕姷绱掓潏銊﹀鞍闁瑰嘲鎳樺畷婊堝箵閹烘垵顥庡┑锛勫亼閸婃牠宕归崼鏇熷仭闁宠桨鑳堕弳锕傛煛閸ャ儱鐏╃紒鐘崇洴閺岋絽螖閳ь剟鎮ц箛娑樺偍闁汇垻鏁哥壕钘壝归敐鍛棌闁稿骸绻橀弻锝堢疀閺冨倻鐤勯梺绯曟櫆閻╊垰顕i鈧崺鈧い鎺嶈兌閳瑰秴鈹戦悩鍙夋悙闁活厽顨呴…璺ㄦ崉閻氭潙浼愬銈庡亝鐢帟鐏冮梺缁橈耿濞佳勭閿曞倹鍋ㄦい鏍ㄧ☉缁椻晠鏌h箛鎾虫殲缂佺粯绻堥幃浠嬫濞磋翰鍨介弻娑㈡偆娴e摜浠╅梺瀹狀嚙缁夊綊鐛Ο鑲╃<婵☆垶鏀辩€氳棄鈹戦悙鑸靛涧缂傚秳绶氳棢闁规儳顕埢鏃堟煠绾板崬澧扮痪鎯с偢濡懘顢曢銏犵闂佹椿鍘介悷褔鍩€椤掍緡鍟忛柛鐘冲哺瀵偅绻濆銉㈠亾娴h倽鏃堝川椤撶媭妲规俊鐐€栭崝褔姊介崟顖涙櫖婵°倐鍋撻柍瑙勫灴閹瑥顔忛鍏碱啀闂備礁鎲¢…鍡涘炊閵娿儰妲愰梻渚€娼ц墝闁哄懏绋撴竟鏇°亹閹烘挾鍘介梺闈涚箳婵敻宕悙鐑樼厱閻庯急鍐ㄢ拤缂備胶绮惄顖氱暦閸楃倣鏃堝礃椤忓秴鏁瑰┑锛勫亼閸婃洖霉濮橆厾顩查柣鎰仛椤洟鏌熼悜姗嗘當闁绘帒鐏氶妵鍕箳閹存繍浠肩紓浣插亾闁告劦鍠楅悡鍐偠濞戞巻鍋撻崗鍛棜缂傚倸鍊峰ù鍥敋瑜嶈灋婵犻潧顑呴拑鐔兼煥濠靛棭妲哥紒鐘崇⊕閵囧嫰骞樼捄鍝勫濠碘槅鍋勫Λ婵嗩潖閸濆娊铏规嫚閹绘帞顔戦梻浣藉吹閸熸瑩宕惰閸旓箑顪冮妶鍡楃瑨闁哥姵鑹惧玻鍧楀箛椤撶姷顔曢梺鍛婄懃椤ャ垽顢旈崼姘e亾閺冨牆绀冮柍鍝勫枤濞村嫰鏌f惔顖滅У濞存粍绻傚嵄妞ゆ帒瀚埛鎴︽⒑椤愩倕浠滈柤娲诲灡閺呭爼顢涢悙瀵稿帾闂佹悶鍎滈崘鍙ョ磾婵°倗濮烽崑鐐垫暜閹烘鏁囬柛蹇曞帶缁剁偤鎮楅敐鍥舵毌闁稿鎹囧浠嬪Ω瑜忛鏇㈡煟鎼淬垻鈯曞畝锝呮健閹瞼鈧綆鍓涚壕鍏笺亜閺冨洤袚鐎规洖鐬奸埀顒侇問閸犳牠鈥﹂悜钘夌畺闁靛繈鍊栭崑鍌炲箹鐎涙ḿ绠橀柣鎰躬濮婄粯鎷呴崨濠傛殘濠电偠顕滅粻鎾崇暦閵忕姭鍫柛鈾€鏅滄瓏婵犵數鍎戠徊钘壝洪妶澶嬫櫇妞ゅ繐鐗忓畵渚€鏌涢埄鍐ㄥ毈婵¤尪顕ч埞鎴﹀焺閸愩劎绁峰銈庡幖閸㈣尪鐏嬫繛杈剧悼閹虫挾娆㈤悙鐑樺€甸柨婵嗛婢т即鏌i敃鈧悧濠勬崲濠靛鍋ㄩ梻鍫熷垁閵忋倖鐓曞┑鐘插暞閸婃劖銇勯姀鈩冾棃妞ゃ垺娲熼弫鍌炴偩鐏炶棄绠哄┑锛勫亼閸婃牠骞愭ィ鍐ㄧ獥閹肩补鍩楄ぐ鎺濇晪闁逞屽墴瀵鏁嶉崟顏呭媰缂備緡鍨卞ú鏍ㄧ閸撗€鍋撶憴鍕婵炶绠戦埢鎾诲即閵忊檧鎷洪梻渚囧亞閸嬫盯鎳熼娑欐珷閻庣數纭堕崑鎾舵喆閸曨剛锛涢梺鍛婎殔閸熷潡顢氶敐澶婄9闁绘洑鐒﹂瀷闂傚倷绀侀幖顐⑽涢幘顔解挃闁告洦鍨版闂佸憡娲﹂崹鎵不濞戙垺鐓曢柟鎹愬蔼閸忓矂鏌¢崱娆徯ョ紒杈ㄦ尰閹峰懘骞撻幒宥咁棜闂備浇顕ч崙鐣岀礊閸℃稑纾诲ù锝呮贡椤╁弶绻濇繝鍌滃闁绘挻鐟╅弻锝夊箣閻忔椿浜幃鐐烘倷椤戣法绠氶梺鐓庛偢椤ゅ倸岣块幇鐗堢厪闁搞儜鍐句純婵犵绱曢崗姗€銆佸☉妯峰牚闁告劑鍔庨崢鎺楁⒒閸屾瑧顦﹂柣銈呮喘閿濈偞寰勯幇顒€鐎梺绉嗗嫷娈旂紒鐘崇墬缁绘盯宕卞Ο璇查瀺闂佹悶鍊栭崹鍫曞Φ閸曨垰绠崇€广儱娲ゆ俊浠嬫⒑閸濄儱校闁绘绮庡Σ鎰板箻鐠囪尙锛滃┑鐐叉閸ㄨ偐绮eΔ鍛拺闁告縿鍎辨牎濡炪們鍔岄敃顏堟偘椤曗偓楠炲洭寮剁捄顭戞Ф闁荤喐绮岀粔鐟扮暦閻熸壋鏀介柛鈥崇箲閺傗偓闂備胶绮敋闁汇倕娲︾粩鐔奉潨閳ь剟寮诲☉銏犵疀闁靛ǹ鍎版竟鏇㈡⒒娴h棄鍚归柛鐘冲姉閸掓帒顓奸崶褍鐏婇柣蹇曞仧閺咁偊鐛幘缁樼厱鐟滃酣銆冮崨鏉戠闁逞屽墮椤啴濡堕崱妯烘殫闂佸摜濮甸幑鍥х暦閿濆绀嬫い鏍ㄤ緱濡懎顪冮妶鍡楀闁搞劎鍎ゅ鍕礋椤栨稓鍘靛┑顔界箓閼活垶宕ヨぐ鎺撶厵鐎瑰嫭澹嗙粔娲煛娴h宕岄柟顔规櫅閻g兘宕惰缁犲搫鈹戦敍鍕杭闁稿﹥鐗犻獮鎰偅閸愩劎鐛ラ梺瑙勫礃椤曆呯不閻樼粯鐓曢柕澶樺枛婢ь垶鏌i幘瀵告创闁诡喗锕㈤幃娆撳箵閹哄棙瀵栨繝鐢靛仦瑜板啴顢氶銏犵劦妞ゆ帊绶¢崯蹇涙煕閻樿櫕绀堥柛鎺撳笒閳诲酣骞囬鍡欑暰闂備礁澹婇崑鍛洪弽顐㈩棜闁稿繐鍚嬮崣蹇旀叏濡も偓濡绂嶅⿰鍕╀簻闁靛绠戦崫鐑樻叏婵犲嫮甯涢柟宄版嚇瀹曘劍绻濋崒娑欑暭闂傚倷绀侀幉鈥愁潖閻熸噴娲冀椤掑倷鑸繝鐢靛Х閺佸憡鎱ㄩ幘顔肩9閻庨潧鎽滅壕鑺ユ叏濮楀棗骞戝ù婊勭矒閺岀喖鎮滃Ο铏逛淮濡炪倕娴氭禍顏堝蓟瀹ュ鐓ラ悗锝庝簼鐠囩偤姊洪崫鍕拱缂佸鎸荤粋鎺楁晝閸屾氨顦悷婊冮叄瀹曟娊顢涢悙绮规嫼缂備礁顑堝▔鏇犵不娴煎瓨鐓涢柛顐亜婢ф潙鈹戦敍鍕毈鐎规洜鍠栭、娑橆潩閸忚偐绉遍梻鍌欒兌缁垶鎮烽妷鈺佺疇閹兼番鍨归閬嶆煙閹殿喖顣奸柍閿嬪灴閹宕烽鐑嗏偓宀勬煕閵堝棛鎳呯紒杈ㄥ笚瀵板嫮浠﹂幆褎鐣俊鐐€栧ú鈺冪礊娓氣偓閻涱喖顫滈埀顒勩€佸▎鎴濇瀳閺夊牄鍔庣粔閬嶆⒒閸屾瑨鍏岀紒顕呭灥閹筋偄顪冮妶鍡樷拹闁绘濮撮悾鐑筋敆閸愶缚姹楅梺鍦劋閹告挳骞忕紒妯肩閺夊牆澧界粔顒併亜椤愩埄妯€鐎规洘鍨块幃鈺冪磼濡厧骞堥梺鐟板悑閻n亪宕瑰ú顏勎︽繝闈涚墐閸嬫挾鎲撮崟顒傤槰缂備緡鍠栭惌鍌炲春閵忊剝鍎熼柕濞垮劤椤旀帡姊洪崨濠傚鐟滄澘鍟埢鎾诲Χ閸涱亝鏂€闂佺粯鍔曢悺銊т焊娴煎瓨鐓曢柍杞扮閺嗭絿鈧娲橀崹鍧楃嵁濡偐纾兼俊顖滃帶楠炴劙姊虹拠鑼闁稿绋掗弲鍫曟寠婢规繆娅i埀顒佺⊕閿曗晛鈻撴禒瀣厽闁归偊鍓欑痪褔鏌涢悩鎴愭垶绌辨繝鍥舵晝闁靛繒濮靛▓顓㈡⒑鐎圭姵顥夋い锔诲灦閸┿垺鎯旈妸銉ь吅濠电姴锕ら悧鍡樼閹邦兘鏀介柣妯活問閺嗘粎绱掓潏銊︾鐎规洘鍨块獮瀣晝閳ь剛澹曡ぐ鎺撶厪闁割偅绻嶅Σ鍝ョ棯閹岀吋闁哄本鐩鎾Ω閵壯傚摋缂傚倷鑳舵慨閿嬫叏閻㈢ǹ绠為柕濞垮労濞撳鎮归崶顏勭处濠㈣娲熼弻锝嗘償閵忊晛鏅遍梺鍝ュУ閻楃娀鍨鹃敃鈧悾锟犳焽閿曗偓濞堛劑姊洪崷顓℃闁哥姵鐗犻敐鐐哄川鐎涙ḿ鍘藉┑鈽嗗灡椤戞瑩宕靛▎鎾寸厸濞达絿鐡斿ḿ鎰磼缂佹ḿ绠為柟顔荤矙濡啫鈽夐幒鎾垛偓鐗堢節閻㈤潧浠掗柛鏍█瀹曟鎮╅搹顐犱虎婵犵鈧磭鍩g€规洏鍔戦、鏃堝川椤栨浜炬繛宸簼閸嬧剝绻濇繝鍌氭殶閺佸牓姊洪悙钘夊姕婵☆偄鍟悾宄邦潨閳ь剟銆佸▎鎾冲簥濠㈣鍨板ú锕傛偂閺囥垺鐓冮柍杞扮楠炴ɑ銇勮箛鎾跺婵懓寮舵穱濠囧Χ閸涱喖娅ら梺鎶芥敱閸ㄥ潡寮诲☉妯锋婵☆垶顥撳﹢鍛存⒑缂佹ê绗掗柕鍫熸倐瀵鈽夐姀鐘栥劍銇勯弽銊х煀闁活厽绻堝铏圭矙濞嗘儳鍓遍梺鍦嚀濞层倝顢氶敐澶樻晪闁逞屽墮閻g兘鎮℃惔妯绘杸闂佸壊鍋掗崑鍛扳叿濠电姷顣槐鏇㈠磻閹达箑纾归柡宥庡幖閽冪喖鏌曟繛鍨壔闁挎繂顦柋鍥煥濠靛棗顒㈤柍璇茬焸濮婄粯鎷呴崨濠冨創闂佸搫鐗滈崜鐔煎箚閸曨垼鏁嶉柣鎰级濡差剟姊洪崨濠冨闁搞劍澹嗙划鍫ュ磼閻愬鍙嗛梺鍝勫暙濞诧箓藟婢舵劖鐓曟繝闈涚墕閸斿銇勯妸锝呭姦闁诡喗鐟╅幊鐘活敆閸屻倕鏅ラ梻鍌欑窔濞佳兠洪敃鍌氱婵炲棙鎸惧畵渚€鏌熼悜姗嗘當缂佺姷绮妵鍕冀閵娧€妲堝銈呯箰濠€杈╂閹捐纾兼慨姗嗗厴閸嬫挻顦版惔锝囩劶婵炴挻鍩冮崑鎾淬亜閵忥紕澧电€规洏鍔戦、妯侯潩鏉堚晝鐛ラ梻鍌欐祰濞夋洟宕伴幘鏉戝灁妞ゆ挶鍨归弸浣该归敐澶嗗亾濞戞氨鐣鹃梻渚€娼ч悧鍡涘箠韫囨稑闂繛宸簼閻撶喖鏌熼幆褏鎽犵紒鈧€n喗鐓涚€光偓鐎n剛袦閻庢鍣崳锝呯暦婵傚憡鍋勯柛娑橈攻椤斿繘姊婚崒娆掑厡閺嬵亝銇勯幋婵嗘殻鐎规洘娲熼幃鐣岀矙閼愁垱鎲伴梻浣虹帛濮婂鍩涢崼銉ユ瀬閻庯綆鍠楅悡鍐喐濠婂牆绀堟繛鎴炶壘閸ㄦ繂鈹戦悩瀹犲闁告劏鍋撴俊鐐€栭幐楣冨磻閻斿吋鍋╅柛婵嗗閺€浠嬫煟濡鍤嬬€规悶鍎甸弻锝呂旈埀顒勬晝閿曞倸鐒垫い鎺戝€归弳鈺佲攽椤旇姤灏﹂柍銉畵瀹曠ǹ螖閳ь剛绮堥崒姘肩唵閻犺桨璀﹂崕鎰節閵忊剝宕屾慨濠冩そ瀹曘劍绻濋崘锝嗗闂備焦鎮堕崝宀勬倶濠靛鏁嬮柨婵嗘缁♀偓濠殿喗锕╅崜娆忕暤閸℃稒鈷戠紓浣股戦ˉ鍫熴亜閵夛附灏电紒顕嗙秮閹瑩鎮滃Ο閿嬪闂備礁鎲¢幐鏄忋亹閸愨晝顩叉繝闈涚墢绾惧ジ鎮归崶銊ョ祷妞ゅ浚浜炵槐鎺楀磼濞戞ḿ鐟查梺闈涚墳缂嶄礁鐣峰鈧崺鐐烘倷椤掆偓椤忓綊姊婚崒娆戭槮闁硅绱曢幑銏ゅ磼濠ф儳浜炬慨妯煎帶婢ф挳鏌涢埞鎯т壕婵$偑鍊栫敮鎺楀磹瑜版帒姹叉い鎺戝€甸崑鎾舵喆閸曨剛顦ㄩ梺鎼炲妼濞硷繝鎮伴鍢夌喖鎳栭埡鍐跨床婵犵妲呴崹鍫曞绩鏉堚斁鍋撳顐ょ煓婵﹦绮幏鍛村川闂堟稓绉虹€殿喚鏁婚、妤呭礋椤掆偓娴狀參姊洪棃娴ュ牓寮插☉姘辩焼闁稿本澹曢崑鎾诲礂婢跺﹣澹曢梻渚€鈧偛鑻晶鐗堜繆閸欏濮嶆鐐村笒铻栧┑鐘插暞濞呮棃姊绘担鍛婂暈濞撴碍顨婂畷銏ゆ倷椤掑偆娴勯梺褰掓?閻掞箓宕愰悽鍛婂仭婵炲棗绻愰顏嗙磼閳ь剟宕橀鍡欙紲闁荤姴娲╃亸娆愭櫠閺囩喆浜滈柡鍥朵簽缁夘喗顨ラ悙杈捐€挎い銏$懇閹稿﹥寰勯崱妞惧婵犵數濮电喊宥夋偂閺囥垺鐓冮柍杞扮閺嬨倖绻涢崼鐔哥闁靛洤瀚伴獮姗€鎼归顫樊婵犳鍠栭敃锔惧垝椤栫偛绠柛娑卞灣閻瑦绻涢崱娆忎壕妞ゃ儲鍨垮缁樻媴閸涢潧缍婇、鏍川閺夋垹鐤囬柟鍏肩暘閸斿矂鎮″┑瀣厸闁稿本姘ㄥ銊╂煛鐎n亪鍙勯柡宀€鍠栭弻鍥晝閳ь剚鏅堕幍顔剧<闁归偊鍠栨禒锔剧磼缂佹ḿ绠為柟顔荤矙濡啫鈽夊Δ浣稿闂傚倷鑳舵灙閻庢稈鏅滅换娑欑節閸パ呯暫閻熸粌绉归敐鐐测攽鐎n偄娈濈紒鍓у钃遍悗姘偢濮婄粯鎷呴崨濠傛殘缂備礁顑嗛崹鍧楀极閸愵喖唯闁挎洍鍋撶紒鍓佸仱閺屾盯寮撮妸銉т画闂佺粯鎸诲ú姗€骞堥妸銉富閻犲洩寮撴竟鏇犵磽閸屾瑨鍏屽┑顔炬暬閹囨偐鐠囧弬銉ッ归敐鍥┿€婇柡瀣叄閺岀喖骞嗚閺嗚京鈧鎸稿Λ婵嗩潖濞差亝顥堟繛鎴欏灮瀹曨亞绱撴担浠嬪摵婵炶尙鍠庨悾鐑藉閿涘嫷娴勯柣搴秵閸嬪棝宕㈤悽鍛娾拺闁绘挸瀛╃拹鈥愁熆瑜庨〃澶愬Φ閹邦垼妲剧紓浣介哺鐢€愁嚕婵犳艾唯鐟滃繘寮抽锔藉€垫繛鍫濈仢閺嬬喎鈹戦悙璇ц含鐎规洘妞介弫鎾绘偐閹绘帞鐛╂俊鐐€栭幐楣冨磻濞戞ǚ鏋旈柕鍫濇缁诲棝鏌i幇鍏哥盎闁逞屽墯濞叉粓骞戦姀銈呯疀闁绘鐗嗘禍杈ㄧ節閻㈤潧孝婵炶绠撳畷鎴﹀磼閻愬鍘搁梺鎼炲劗閺呮盯寮稿鍥╃<閻犲洤寮堕ˉ鐐烘煏閸パ冾伃鐎殿喕绮欐俊姝岊槾闁绘挸鍊块弻锝夊閳轰胶浠梺鐑╂櫓閸ㄥ爼鐛崘銊庣喓鎹勯妸褎婢戦梻渚€娼ч敍蹇涘川椤旂瓔鍟岄梻鍌氬€风粈渚€骞栭锝呯窞闁搞儺鍓欓悞鍨亜閹哄棗浜剧紒鍓ц檸閸欏啫顕i幎钘夊耿婵炴垶鐟ч崢鎾绘偡濠婂嫮鐭掔€规洘绮撻幃銏☆槹鎼淬垺顔曞┑鐐存綑閸氬岣垮▎鎾崇闁逞屽墮椤啴濡堕崱妯洪瀺婵犮垼顫夊ú鐔风暦閹达箑绠婚悗娑櫭鎾剁磽娓氬洤鐏℃繛鍙夛耿閿濈偛顓奸崨顏呮杸濡炪倖姊婚悺鏂库枔閺冣偓娣囧﹪顢曢敐鍥ㄥ櫚閻庤娲橀幑鍥箖娴犲宸濆┑鐐靛亾鐎氬ジ姊绘担鍛婂暈缂佸鍨块弫鍐Χ閸℃ê寮块梺鎼炲劘閸斿鎹㈤崱妯镐簻闁哄秲鍔庨崯鏌ユ煛閳ь剚绻濆顓炩偓鐢告⒒閸喓鈼ら柛瀣ㄥ灮閳ь剝顫夊ú姗€鏁冮姀銈冣偓浣糕枎閹寸偛鏋傞梺鎸庣箓濡顢旈悜妯肩瘈闁汇垽娼ф禒鈺呮煙濞茶绨界紒杈╁仦缁楃喖鍩€椤掑啯锛傞梻浣筋潐閸庢娊顢氶銏犵厺闁哄啫鐗婇悡鐘电棯閺夊灝鑸瑰褎澹嗛惀顏堝箚瑜嬮崑銏ゆ煛瀹€鈧崰鎾舵閹烘嚦鐔兼惞閸︻厽鍣梻鍌欑劍婵炲﹪寮ㄩ崡鐐嶆盯宕橀鑹版憰闂佺粯妫侀崑鎰暤娓氣偓閺屾盯鈥﹂幋婵囩亾婵炲鍘ч悧鎾诲箖濡ゅ啯鍠嗛柛鏇ㄥ墰椤︻參姊洪崨濠庣劶闁搞儜鍛箣闂備胶顢婇幓顏嗙不閹达附鐓侀柛銉墯閻撶喖鏌¢崒姘变虎妞ゃ儱绻橀弻娑㈡偄閻戣棄寮板┑顔硷工椤嘲鐣烽幒鎴旀瀻闁圭儤鍨电敮顖滅磽閸屾瑧璐伴柛锝庡櫍瀹曡瀵兼潏鍓х◤闂婎偄娲﹀鑽ゅ姬閳ь剙鈹戦鏂や緵闁告挻鐩畷銏ゆ焼瀹ュ棌鎷洪梺鍛婃尰瑜板啯绂嶉弽顓熺厱閹兼番鍔嬮幉鍓р偓娈垮枛閹诧紕绮悢鐓庣劦妞ゆ帒瀚拑鐔哥箾閹存瑥鐏╅柣鎺撴そ閺屾盯骞囬崗鍝ユ寜婵犳鍠栧ú顓烆潖閾忓湱纾兼俊顖濐嚙闂夊秴鈹戦悙璺虹毢闁哥姵鐗犻悰顕€宕橀…鎴炲缓闂侀€炲苯澧存鐐插暙閳诲酣骞樺畷鍥崜闂備胶鎳撻顓熷垔椤撶倣锝夊级鎼存挻鏂€闂佺粯锕╅崰鏍倶鏉堛劊浜滄い鎰╁焺濡叉悂鏌e⿰鍡楀惞闁圭懓瀚版俊鎼佹晜缂佹ḿ绋愰梻鍌欑濠€閬嶅磿閵堝鈧啴宕卞☉妯硷紱闂佸綊鍋婇崢瑙勭濠婂牊鐓涢柛鎰╁妼閳ь剙鎽滈弫顔炬崉鐞涒剝鏂€濡炪倖鏌ㄩ幖顐︽倶椤斿墽纾奸弶鍫涘妽鐏忎即鏌熷畡鐗堝櫤缂佸倹甯為埀顒婄秵娴滄繈骞婂▎鎾粹拻濞达絽鎲$拹锟犳煙閾忣偅灏悡銈夋煏閸繍妲归柛瀣ф櫊閺岋綁骞嬮敐鍡╂缂備胶濮垫繛濠囧蓟閻旂厧绠规い鎾跺仜缁犳椽姊虹粙璺ㄐф繛浣冲洠鈧棃宕橀鍢壯囨煕閳╁喚娈樺ù鐓庢搐閳规垿鍩ラ崱妞剧盎闁诲孩鍑归崢鍓у垝鐎n亶鍚嬮柛鈩冨姇娴滄繈姊洪崨濠傚闁哄懏绻堝畷銏ゆ偨閸涘ň鎷婚梺绋挎湰閼归箖鍩€椤掍焦鍊愭い銏″哺椤㈡﹢鍩楅崫鍕枠闁轰礁鍊垮畷婊嗩槼闁挎稑绻樺铏规嫚閳ュ磭鈧鏌涘☉鍗炵€洪柕濞炬櫆閳锋垿鏌涘┑鍡楊伀闁绘帟娉曠槐鎾愁吋閸曨厾鐛㈤梺缁樹緱閸犳岸鍩€椤掑﹦绉甸柛鐘愁殜瀵煡寮婚妷锔惧幈濠电偞鍨惰摫闁革絾妞介弻鐔兼偡閻楀牆鏋犻悗娈垮枦椤曆囧煡婢跺ň鏋庨柟瀵稿Х濡插洭姊绘担鍛靛綊寮甸鍌滅煓闁瑰鍋熼々鐑芥煙缂併垹鏋熼柍閿嬪灴閺屾稑鈹戦崱妤婁紓濡炪値鍋撶粻鎾诲蓟濞戙垹绫嶉柍褜鍓熷畷褰掓偨閸撳弶鏅梺鎸庣箓椤︻垳绮荤紒妯镐簻闁哄啫娲﹂ˉ澶愭煃瑜滈崜鐔煎绩鏉堚晜宕叉繛鎴欏灩缁狙囨煙閹碱厼骞栭柛鎾跺缁绘稓鈧稒岣块惌濠傤熆瑜岀划娆撶嵁婢舵劕绠瑰ù锝囨嚀娴滈亶姊洪崜鎻掍簼缂佽瀚伴幃鐑藉Ω閳哄倵鎷哄┑顔炬嚀濞层倝鍩€椤掍緡娈滅€规洘鍨块獮妯兼嫚閸欏偊绠撻弻娑㈠即閵娿儲鐏撻梺姹囧€愰崑鎾绘⒒娴e憡璐¢柛瀣崌瀹曟粌顫濋鐙€娴勯梻渚囧墮缁夌敻鍩涢幋锔藉仩婵炴垶宸婚崑鎾诲礂閸涱収妫滃┑鐘垫暩閸嬫盯顢氶鐔稿弿闁圭虎鍣弫鍕煕閳╁啰鈯曢柛瀣€块弻锝夊籍閸喐鐝崇紓浣筋嚙濡瑩濡甸崟顖氬唨闁靛ě鍜佸悑闂備焦鎮堕崐鏍偡閵夆斁鈧箓鎳楅锝嗩€囬梻浣规偠閸斿矂鎮ラ悡搴殨閻犲洦绁村Σ鍫ユ煏韫囧ň鍋撻崗鍛泿婵犵绱曢崑娑㈩敄閸涱劶褰掓倻缁涘鏅╅梺鍦劋椤ㄥ棝鍩涢幋锔界厱婵犻潧妫楅顏呯節閳ь剚瀵肩€涙ḿ鍘介梺鍐叉惈閿曘倝鎮橀敂绛嬫闁绘劖褰冮弳锝夋煕閳规儳澧查柟宄版嚇閹粌螣濞茶鏅梻鍌氬€烽悞锕傚箖閸洖纾挎繝濠傜墕閻掑灚銇勯幒鎴濐仼缂佺媭鍨伴湁闁绘挸娴烽幗鐘绘煟閹捐泛鏋涙鐐寸墪鑿愭い鎺嗗亾闁逞屽厵閸婃洖鐜婚崸妤€绠涙い鎾跺Х椤旀洟鏌i悩鍙夊巶闁告侗鍨卞▓濂告煟鎼淬値娼愭繛鍙夌墱缁辩偞绻濋崒婊勬婵犻潧鍊绘灙闁告濞婇弻锝呂熼崹顔炬闂侀潧鐗炵粻鎾诲蓟閿濆棙鍎熼柨娑樺閺嗘盯姊虹粙鍧楀弰濞存粍鍎煎Λ鐔哥箾鐎电ǹ孝妞ゆ垵鎳樺鍛婃媴缁洘鏂€闂佺粯蓱瑜板啴顢旈銈囨/闁诡垎鍐╁€紓浣虹帛閻╊垶鐛€n喗鍊婚柛銉鏉╂棃姊绘担鍛靛湱鈧稈鏅犲畷婵單旈崘鈺婃綗闂佸湱鍋撻崜姘跺触鐎n喗鐓曢柍閿亾闁哄懏绮撻幃鎸庢媴缁洘鏂€濡炪倖姊婚妴瀣礉閻旇櫣纾兼い鏇炴噹閻忥附顨ラ悙鑼鐎规洏鍔戝鍫曞箣濠靛牏宕烘繝鐢靛Х閺佸憡鎱ㄩ幘顔肩疇闁规媽鍩囬埀顑跨窔瀹曘劎鈧稒菤閹风粯绻涙潏鍓у埌闁硅櫕鐟╁畷鐑筋敇閳ユ壙鈥斥攽閻愬弶鈻曞ù婊勭矌婢规洝銇愰幒鎾跺幐闂佹悶鍎撮崺鏍濞戞氨纾界€广儱妫涙晶鐢告煟閹垮啫浜扮€规洖鐖兼俊姝岊槷濠殿喖娲铏圭矙濞嗘儳鍔€缂備胶绮换鍫濐嚕婵犳碍鍋勯悘蹇庣劍閻忎線姊洪崜鑼帥闁哥姵顨婇幃妯侯吋閸涱亝鏂€闂佺粯鍔樼亸娆愭櫠閵忋倖鐓曢悗锝庡亝鐏忕敻鏌熼獮鍨仼闁宠鍨归埀顒婄秵娴滆泛岣挎繝鍥ㄢ拺闁圭ǹ娴风粻鎾绘煙閾忣偄濮嶇€规洏鍨介、鏇㈡晜鐟欙絾瀚奸梻浣告啞缁嬫垿鏁冮妷鈺佺厱闁规壆澧楅悡鐔镐繆閵堝懎鏆欓柍璇茬墛椤ㄣ儵鎮欓幓鎺撴闂佽桨鐒﹂幑鍥箖閳哄懏鎯炴い鎰剁悼瑜板憡绻濋悽闈浶為柛銊у帶閳绘柨鈽夐姀鈥虫濡炪倖鐗楃缓鎸庣瑜版帗鐓曢柡鍥ュ妼閻忥繝鏌嶉柨瀣伌闁哄瞼鍠栭幊鏍煛娴i鎹曢梻浣告啞濮婂綊鏁冮姀銈呰摕婵炴垯鍨瑰Λ姗€鏌涜椤ㄥ懎顕f导瀛樷拺缂侇垱娲橀弶娲煕閵娿倗鐭欓柣娑卞枛铻i柤娴嬫櫇閿涙粌鈹戦埥鍡楃仯闁告鍥╁祦闁割偁鍎查埛鎴︽偣閸ャ劌绲婚柛銈堜含缁辨挸顓奸崨顕呮&閻庤娲橀崹鍨暦閵娾晩鏁嶆繛鍡樺灥婢х偓淇婇悙顏勨偓鏍箰閸洖鍨傛繛宸簼閸嬪倿鏌涢幇闈涙灍闁绘挶鍨烘穱濠囶敍濞嗘帩鍔呭┑鈽嗗灠閻楀﹥绌辨繝鍥х闁圭儤鎸搁弳鍫ユ⒑闂堟稒鎼愰悗姘嵆閵嗕線寮撮姀鈩冩珳闂佹悶鍎弲婵嬪级娴犲鐓熼幖娣€ゅḿ鎰箾閸欏鐭掓鐐诧躬楠炴ḿ鎷犻懠顒€寮ㄥ┑鐘灱濞夋稖澧濋梺鍝勵儏闁帮綁寮婚悢鍏肩劷闁挎洍鍋撴鐐搭殜閺岋綁鏁傞悾宀€鐓傜紓浣介哺閹瑰洤鐣烽幒鎴僵妞ゆ垼妫勬禍楣冩煙闂傚顦︾痪鎯х秺閺岀喖姊荤€靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ょ紓宥咃躬瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁绘劦鍓欓崝銈囩磽瀹ュ拑韬€殿喖顭烽幃銏ゅ礂鐏忔牗瀚介梺璇查叄濞佳勭珶婵犲伣锝夘敊閸撗咃紲闂佽鍨庨崘锝嗗瘱闂備胶顢婂▍鏇㈠箲閸ヮ剙鐏抽柡鍐ㄧ墕缁€鍐┿亜韫囧海顦﹀ù婊堢畺閺屻劌鈹戦崱娆忓毈缂備降鍔岄妶鎼佸蓟閻斿吋鍎岄柛婵勫劤琚﹂梻浣告惈閻绱炴笟鈧妴浣割潨閳ь剟骞冨▎鎾崇妞ゆ挾鍣ュΛ褔姊婚崒娆戠獢婵炰匠鍏炬稑鈻庨幋鐐存闂佸湱鍎ら〃鎰礊閺嶃劎绡€闂傚牊渚楅崕鎰版煛閸涱喚鍙€闁哄本绋戦埥澶愬础閻愬樊娼绘俊鐐€戦崕鎻掔暆缁嬫娼栧┑鐘宠壘绾惧吋绻涢崱妯哄闁靛牊婢橀—鍐Χ閸℃ḿ顦ㄩ梺缁橆殘婵挳鎮炬搴㈠枂闁告洦鍋掗崵銈夋煟鎼淬垻鈯曢柨姘舵煕閹惧磭绉烘慨濠呮缁瑩骞愭惔銏″婵犳鍠楄彠闁告梹鍨甸锝夊箮閼恒儲娅囬梺绋挎湰缁嬫捇宕㈤悽鍛娾拺缂備焦锚閻忥箓鏌ㄥ鑸电厽闊洦鎸炬牎婵烇絽娲ら敃顏堢嵁閹捐绠抽柡鍌涱儥閺夋悂姊绘笟鈧埀顒佺〒閳规帡鏌涢弬璺ㄧ劮闁诲繑甯″娲川婵犲嫮鐣甸柣搴㈠嚬閸欏啫鐣烽幇閭︽晬闁绘劗琛ラ幏缁樼箾鏉堝墽绋婚柡瀣帛椤ㄣ儴绠涘☉娆戝幈婵犵數濮撮崯鎵不閹炬番浜滄い鎰╁灮缁犲磭绱掓潏銊ョ瑨閾伙綁鎮归崶褎鈻曢柍褜鍓氶幐鍓ф閹惧瓨濯撮柛鎾村絻閸撳崬顪冮妶鍡楃仸闁荤喆鍎撮悘瀣倵閸忓浜鹃梺鍛婃处閸忔﹢骞忛搹鍦=濞达絽澹婇崕鎰亜閹寸偟鎳囩€规洘娲濈粻娑樷槈濞嗘垵骞嶉梻浣告啞閸旀洖顕i崼鏇炵闁挎繂顦伴悡鏇熺箾閸℃绠查柛銈呮处閹便劍绻濋崘鈹夸虎閻庤娲﹂崑濠傜暦閻旂⒈鏁囨繛鎴炵懅閳ь剟浜跺缁樻媴閸涘﹤鏆堥梺鎸庡哺閺屾洟宕奸埗璺虹秺閹箖鎮滈懞銉︽珳闂佺硶鍓濋悷褔鎯侀崼銉︹拺闁硅偐鍋涢崝姗€鏌涢弬鍧楀弰鐎规洏鍨介、鏃堝川椤栨粎妲囬梻渚€娼ф蹇曞緤閸撗勫厹闁绘劦鍏涚换鍡樸亜閹板墎鎮奸柟鍐插暣閺屽秶鎷犻懠顑呪偓瑙勬礀瀹曨剟鍩ユ径濞炬瀻闁瑰瓨绻傜粻娲⒒閸屾瑦绁版い顐㈩樀瀹曟洟骞庨懞銉ヤ槐闂侀潧臎閸涱垳鍔堕梺璇插嚱缂嶅棝宕板Δ鍛亗婵炴垶鍩冮崑鎾诲礂婢跺﹣澹曢梺璇插嚱缂嶅棝宕滃☉銏″剨闁割偁鍎查崐鐢告偡濞嗗繐顏紒鈧埀顒勬⒑缂佹ḿ澧柛姘儐缁岃鲸绻濋崶銊モ偓濠氭煢濡尨绱氶柕濞炬櫆閻撳繐顭块懜寰楊亪寮搁妶澶嬬厓鐟滄粓宕滃顓犵濠电姴鍋嗗ḿ鏍磽娴h偂鎴炲垔鐎靛摜纾兼繛鎴烇供閸庡繑绻涢崼顐㈠箻缂佽鲸鎸婚幏鍛存惞閻熸壆顐奸梺姹囧焺閸ㄩ亶銆冩繝鍥╁祦闁割偁鍎辨儫闂佹寧姊荤划顖涙櫏闂備胶鎳撻崥瀣偩椤忓牆鏄ラ柛鏇ㄥ€跨紓姘舵煟閺傚灝鎮戦柍閿嬪灴閺屾盯鏁傜拠鎻掔闂佸憡鏌ㄩ鍡涘Φ閸曨垰惟闁靛绠戝▓妤呮⒑鐠団€虫灓闁稿鍊曢悾鐤亹閹烘繃鏅濋梺缁樓规禍顒勬儎鎼淬劍鈷掑ù锝呮啞鐠愶繝鏌涙惔娑樷偓婵嗙暦瑜版帗鍋ㄩ柛鎾冲级閺呮粓姊洪崘鍙夋儓闁哥喐澹嗘竟鏇熺附閸涘﹦鍘撻悷婊勭矒瀹曟粓鎮㈡搴㈡濠殿喗銇涢崑鎾绘煕閳哄啫浠︾€垫澘瀚板畷顐﹀Ψ瑜庨弲銊╂⒒閸屾艾鈧悂銈幘顔肩;闁告洦鍊嬪ú顏呮櫇闁稿本姘ㄩ鍥ㄧ節閻㈤潧校闁煎綊绠栧濠氼敍濠婂嫬鏋戦梺缁橆殔閻楀棛绮鑸电厽闁规儳顕ú鎾煙椤旂瓔娈滈柡浣瑰姈閹棃鍨鹃懠顒傛晨闂傚倷娴囬褏鎹㈤幇鐗堝仱闁靛⿵濡囬埞宥呪攽閻樺弶绁╅柡浣稿暣閺屾洝绠涙繛鎯т壕闁惧浚鍋嗛弳顒€鈹戦敍鍕杭闁稿﹥鍨垮畷褰掑传閸旇姤妞介幃銏ゅ川婵犲倸浼庨梻渚€鈧偛鑻晶鎾煛鐏炵晫效濠碉紕鍏橀弫鍐焵椤掍焦娅犳い鏍ㄧ◥缁诲棝鏌ら悡搴e煟闁告繆娅g槐鎺旂磼濡偐鐤勯梺璇″枙缁瑥螞閸愩劉妲堟俊銈呭暞瀹曠喖姊虹拠鎻掝劉妞ゆ梹鐗犲畷浼村冀閵婏附鐝烽柟鍏肩暘閸斿瞼绮堥崱娑欑厵闁绘垶锕╁▓鏃傜磼閻樺樊鐓奸柟顔肩秺瀹曞爼顢旈崟顓燁嚄闂備椒绱紞浣虹不閺嶎厼绠栨俊銈呮噹缁€鍌氼熆鐠虹尨姊楀瑙勬礋濮婄粯鎷呴崨濠傛殘濠电偠顕滅粻鎾崇暦閹达箑绀嬫い鏍ㄧ☉濞堝矂姊洪崜鑼帥闁哥姵甯″銊︾鐎n偆鍘介梺褰掑亰閸樼晫绱為幋锔界厽闊洢鍎抽悾鐢告煛瀹€瀣М闁诡喓鍨归埞鎴﹀幢濡粯鍊烽梻浣呵圭悮顐﹀礉閹达箑钃熼柣鏃傚帶缁€鍫㈡喐韫囨洘鏆滄繛鎴欏灪閻撴洟鎮楅敍鍗炲暙閳峰绱撴担铏瑰笡缂佽鍟伴幑銏犫攽鐎n亞锛滃┑顔斤耿濡法妲愰幋锔解拻濞达綀顫夐妵鐔兼煕濡吋娅曢柡渚囧櫍閹瑩宕崟顓炲Е婵$偑鍊栫敮鎺楀窗濮橆兗缂氶柟閭﹀幘缁犻箖鏌涘▎蹇fС缂傚倹宀搁弻娑㈠箳閹捐櫕璇炲Δ鐘靛仦宀e潡骞忛悩缁樺殤妞ゆ帒鍊瑰В鍥⒒閸屾瑧绐旀繛浣冲嫷娈介煫鍥ㄦ礃椤洟鏌¢崶銉ョ仾闁抽攱妫冮弻娑㈠即閵娿儰鑸梺缁樻煥濡繈骞冪憴鍕闁瑰嘲鐭堥崝鍛存⒑缁嬪灝顒㈤柛銊ユ贡濡叉劙骞掗弬鍝勪壕闁挎繂鍊瑰▍鍥╃磼閹邦厽鈷愰柟渚垮妽缁绘繈宕熼鐐殿偧闂備胶鎳撻崲鏌ュ箠濮椻偓楠炲啴鎮滈挊澶岄獓闂佸壊鐓堥崯鈺呭箣閻樼數锛濋梺绋挎湰閻熴劑宕楀畝鈧槐鎺楊敋閸涱厾浠搁梺闈涙閸燁垳鎹㈠┑瀣倞闁靛⿵闄勯悵鎶芥⒒娴h櫣甯涢柛鏃€鐗曞玻鍨枎閹寸儐鍋ㄩ梺缁樺姉閸庛倝宕愰崼鏇熺厽闁归偊鍠楅銏ゆ偡濞嗗繐顏い鈺傜叀閺岋綁骞囬棃娑橆潽闂佸憡鐟ョ换鎴﹀箞閵娿儙鏃堝焵椤掆偓铻炴俊銈呮噽瀹撲線鏌″搴″箺闁绘挻娲樼换婵嬫濞戞瑥顦╅梺闈涙处缁诲牓寮婚敍鍕勃缂侇垱娲栨禍鍓р偓瑙勬礀濞诧箑鈻撻弴銏♀拺闂侇偆鍋涢懟顖涙櫠鐎电硶鍋撶憴鍕;闁告濞婇悰顔碱潨閳ь剟骞婂⿰鍐f灁闁圭ǹ娴风粙鎰版⒒閸屾瑧顦︽繝鈧柆宥呯?闁靛牆顦崥褰掓煥閺囩偛鈧綊宕戦崟顖涚厱婵炴垶锕銉︺亜椤愵剛绡€婵﹥妞藉畷顐﹀礋閸倣锕傛⒑鐠囪尙绠茬紒璇茬墦楠炲啫螣閼姐倗鎳濋梺閫炲苯澧い顐㈢箲缁绘繂顫濋鍌︾床婵犵數鍋涘Λ娆撳春閸惊锝夘敋閳ь剙顫忛搹瑙勫厹闁告粈绀佸▓婵堢磽娴h櫣甯涚紒璇插€块、姘舵晲閸℃瑧鐦堝┑顔斤供閸庣敻鍩¢崨顔惧帗闁诲海顣介埀顒€鍟块弳鐐差熆鐠哄搫顏紒缁樼洴閹剝鎯旈敐鍥跺晪闂備胶纭堕弲顏嗘崲濠靛棛鏆﹂柟鐑橆殔鍥撮梺绯曞墲閻熝囧煟閵夆晜鈷掗柛灞捐壘閳ь剙鍢查湁闁搞儺鍓ㄧ紞鏍ь熆閼搁潧濮囩痪鎯ф健閺岀喖骞嗛弶鍟冩捇鏌涚€c劌鈧繈寮婚弴鐔虹瘈闊洦娲滈弳鐘绘⒑閹肩偛濡芥俊顐㈠暣瀵鎮㈤搹鍦紲闂侀潧绻掓慨鐢告倶瀹ュ鈷戠紓浣股戠亸鐗堢箾閼碱剙鏋涚€殿喖顭烽幃銏ゅ礂閻撳簶鍋撻柨瀣ㄤ簻闁瑰搫绉烽崗宀€绱掔€n亝宸濈紒杈ㄦ尰閹峰懘鎮烽幍顔俱偡婵$偑鍊ら崢楣冨礂濡警鍤曢悹鍥ㄧゴ濡插牓鏌曡箛鏇炐ユい鏃€甯¢弻锝夋偐鏉堛劎銈板┑鐐叉噺濞茬喎鐣烽弶娆炬僵闁煎摜顣介幏娲⒑閸涘﹦绠撻悗姘煎櫍閹偟鎹勯妸褏锛濋悗骞垮劚鐎氼噣宕濆澶嬬厵濞撴艾鐏濇慨鍌炴煕閳规儳浜炬俊鐐€栫敮鎺斺偓姘煎弮閹繝宕橀鑲╅獓闂佺粯鍔栧ḿ娆擃敁濠婂牊鐓曢煫鍥ㄦ崄鐎氫即妫佹径鎰厽闁规崘娅曢幑锝咁熆瑜嬮崹鑽ゆ閹烘挻缍囬柕濠忕畱闂夊秹姊洪悷鏉挎Щ闁硅櫕锕㈤獮鏍亹閹烘挸浠梺瑙勵問閸n噣宕戣缁辨捇宕掑顑藉亾瀹勬噴褰掑炊椤掑鏅悷婊勬煥閻g兘骞囬弶鍧楁暅濠碉紕鍋涢惃鐑藉磻閹惧瓨濯撮柛鎾冲级閸嶇敻姊洪懖鈹e綊鎮樺顑芥瀺婵犲﹤瀚弧鈧梺闈涢獜缁蹭粙鎮¢幇鐗堝珔闂侇剙绉甸悡娑㈡煕濞戝崬鏋ょ紒鐘靛仦閹便劍绻濋崘鈹夸虎濠碘槅鍋勯崯顐﹀煡婢跺⿴娼╂い鎺戭槹濮e洭姊婚崒娆掑厡閺嬵亪鏌ㄩ弴妯衡偓婵嬬嵁婢舵劖鏅柛鏇ㄥ幘閻掑潡鎮楅獮鍨姎婵☆偄閰e畷鎴﹀川鐎涙ḿ鍘遍梺纭呭焽閸斿秴鈻嶉崶顒佺厱婵炲棗绻戦ˉ婊堟煃鐟欏嫬鐏撮柟顔规櫇缁辨帒螣婵犳碍鏆樺┑鐘殿暯濡插懘宕戦崨顖涘床闁割偁鍎埀顑跨窔楠炴ê顭块崟顒侇棃鐎规洏鍔戦、娆撳箚瑜嶇粻浼存⒒娴g瓔鍤欓柛鎴犳櫕缁辩偤宕卞☉妯碱槶濠电偛妫欓幐鎼佸礄閻樺磭绠鹃柟瀛樼懃閻忣亪鏌i幘瀵告创闁诡喗锕㈤幃娆撳垂椤愶絿褰ч梺杞扮閻楁挸顫忓ú顏勪紶闁告洦鍣ḿ鍫曟⒑閸涘﹥鐓ラ梺甯秮瀹曟椽鍩€椤掍降浜滈柟鐑樺煀閸旂喓绱掓径鎰锭闂囧绻濇繝鍌涘櫣濞寸媴濡囩槐鎺楀磼濞戞ɑ璇為梺纭呮珪閻楃娀宕洪敓鐘茬妞ゅ繐娴烽梻顖涚節閻㈤潧浠╅柟娲讳簽瀵板﹪鎳栭埡浣哥亰濠电偛妫欓幐鍛婂閻樺磭绠剧€瑰壊鍠曠花濂告煕鐎c劌濡介柕鍥у瀵粙濡歌閻撯偓濠电偛顕繛鈧ù婊冪埣瀵鈽夐姀鐘靛幋闂佽鍨庨崒姘兼濠电姷顣槐鏇㈠磻閹达箑纾归柡宥庡亝閺嗘粓鏌熼悜姗嗘畷闁哄懏绻堥弻銊╁棘閸喒鎸冮梺娲诲幗閹瑰洭寮婚敐澶婎潊闁绘ê鍟块弳鍫ユ⒑缂佹ɑ灏版繛鑼枛楠炲啫螖閸涱喗娅滈柟鑲╄ˉ閳ь剝灏欓惄搴㈢節閻㈤潧浠﹂柟顖氱焸瀹曟澘顫濈捄铏瑰姦濡炪倖甯掗崰姘缚閹邦厾绠鹃柛娆忣棦椤忓棗寮查梻浣虹帛濡啴寮查懠顒佸床闁糕剝绋掗悡鐔兼煙鏉堝墽绋绘い銉ヮ樀閺岋綁骞樼€靛憡鍒涢梺鍝勬湰缁嬫挻绂掗敃鍌氱鐟滃繘鎮¢埀顒佷繆閵堝洤啸闁稿鐩幃褔骞橀幇浣圭稁闂佹儳绻楅~澶愬礂濠婂牊鐓曟繛鎴濆船瀵偓淇婇銏㈠ⅵ婵﹨娅i幉鎾礋椤戝彞鎴峰┑鐐茬摠缁酣宕戝☉妯虹カ闂備礁婀辨晶妤€顭垮鈧畷锟犲箮閼恒儳鍘藉┑鈽嗗灠閹碱偊骞冩担铏圭<婵°倐鍋撴い锔炬暬楠炲啫螖閸愨晛鏋傞梺鍛婃处閸撴盯藝閵夈儮鏀介柣鎰皺濠€鎾煕閺傚灝顒㈢紒鏃傚枛瀵挳鎮㈠ú顏咁€嶇紓鍌欑椤戝牆鈻旈弴鐕佹闁搞儺鍓氶埛鎴︽煕閹炬潙绲诲ù婊勭箘缁辨帞鈧綆鍋勯悘锕€菐閸パ嶈含闁硅櫕鐗犻崺锟犲礃椤忓海搴婂┑鐘茬棄閺夊簱鍋撻幘缁樺€块柨鏇炲€归崕宥夋煙鏉堥箖妾柣鎾冲暟閹茬ǹ饪伴崼婵堫槶濠电偛妫欓幐濠氬磹閼稿灚鍙忔慨妤€妫楁晶濠氭煟閺傛寧顥炲ǎ鍥э躬椤㈡稑顫濇潏銊ф闂備胶枪椤戝棝骞愰幖渚婄稏婵犻潧顑嗛崑鍌炲箹鏉堝墽纾挎い鏃€甯″缁樻媴閻戞ê娈岀紓浣哄Т缁夌懓鐣风涵鍛汗闁圭儤鍨归崢鎾⒑閻熼偊鍤熷┑顕呭弮瀹曟垿骞樼紒妯绘珳闁圭厧鐡ㄧ换鍕极閺嶎厽鈷戦柟绋挎捣閳洜绱掗鑺ュ碍妞ゎ偄绻愮叅妞ゅ繐鎷嬪Λ鍐ㄢ攽閻愭潙鐏﹂柤褰掔畺閵嗗倿宕崟銊︽杸闂佸疇妫勫Λ妤佺濠靛鐓熼柣鏂垮级濞呭﹪鏌曢崱鏇狀槮闁宠閰i獮妯虹暦閸ヨ泛鎮堥梻鍌欑劍鐎笛兾涙担绛嬫毎闂備胶鎳撻崲鏌モ€﹀畡閭︽綎闁惧繐婀遍惌娆撴煙缁嬪灝顒㈤柟鐑戒憾濮婃椽鎳¢妶鍛畬闂佹悶鍎扮粈浣该洪銏犳瀬闁告劦鍠栫壕鍏肩箾閹寸偠澹樻鐐茬Ч濮婃椽鎳¢妶鍛呫垺绻涙竟顖氭搐瀹告繃銇勯弽銉モ偓妤呭触瑜版帗鈷掗柛灞剧懄缁佺増淇婂鐓庡婵炲棎鍨介弫鎾绘偐閼碱剛宕堕梻浣告惈缁嬩線宕滃☉娆戭洸婵炲棙鎸婚埛鎺懨归敐鍛暈闁哥喓鍋ら弻娑㈠棘鐠恒劎顔掗悗娈垮枟瑜板啴銈导鏉戠闁挎繂妫涙禍鏍р攽閻愬樊鍤熼柛妯犲洦鍋ら柕濞炬櫅閻撴洟鏌熸潏楣冩闁绘挻娲熼弻銊╁籍閸ヨ泛娈Δ鐘靛仦閻楃娀寮诲☉銏犳婵炲棙鍎抽崜閬嶆⒑闂堟稒鎼愰悗姘卞娣囧﹪骞栨担瑙勬珖闂侀€炲苯澧柟渚垮妽瀵板嫬鐣濋埀顒傚婵傜ǹ绾ч柛顐g濞呭懎霉閻樿桨鍚柍褜鍓氶鏍窗閺囩姴鍨濇繛鍡樺姃缁诲棙鎱ㄥ┑鍡欑劸婵℃煡绠栧鐑樺濞嗘垹鏆犻梺缁橆殕閹告悂锝炶箛鏃傜瘈婵﹩鍓涢敍婊冣攽椤旂煫顏勭暦椤掑娂鐑藉焵椤掆偓閳规垿鎮欑€涙ê闉嶇紒鐐緲缁夊綊濡撮崘鈺冪瘈闁稿本绮嶅▓楣冩⒑閸濆嫭宸濋柛瀣姇鍗遍柛顐犲劜閻撳繘鐓崶銉ュ姢缁炬儳娼¢弻娑樜熼悜妯烘殘缂備胶绮粙鎺戓缚韫囨稑绀堢憸搴ㄥ磻瑜旈弻锛勨偓锝呭悁缁ㄥジ鏌曢崶褍顏紒鐘崇洴閺佹劙宕ㄩ鐘垫綁闂傚倷绀侀幖顐e緞閸ヮ剙鐒垫い鎺嗗亾缁剧虎鍙冨鎶藉幢濞戞瑥鈧敻鏌ㄥ┑鍡涱€楀褎澹嗛幃顕€鏁傞幋鎺旂畾闂侀潧鐗嗗ú銈呮毄闂備胶枪椤戝棛绮欓幋鐘插疾婵$偑鍊栭幐鎾磻閹捐鐒垫い鎴f硶椤︼箓鎽堕弽顓熺厱婵炴垵宕獮姗€鏌ㄥ☉娆戠煀闁宠鍨块幃娆撳级閹寸姳妗撻梻浣藉吹閸犲棝宕曢棃娑卞殨缂佸绨卞Σ鍫ユ煏韫囧﹥顎嗛柟宄邦煼濮婅櫣绮欓幐搴㈡嫳闂佽崵鍟欓崨顖滃箵闂佸搫鍟犻崑鎾剁磼缂佹ḿ鈯曢柟宄版嚇瀹曟﹢骞撻幒鎴狀啋婵犵數鍋涘Ο濠冪濠靛鐤炬繝濠傜墛閻撶喖鏌熸导瀛樻锭濠⒀屽櫍楠炴牠寮堕幋顖濆惈濠殿喖锕ュ钘夌暦閵婏妇绡€闁稿本顕撮弴銏♀拺闁告縿鍎辨牎闂佺粯顨嗛〃濠囧Υ娴e湱绡€闁搞儯鍔夐幏缁樼箾鏉堝墽鍒伴柟璇х節瀹曨垶鎮欑€靛摜顔曢柣鐘叉厂閸涱垱娈奸柣搴ゎ潐濞叉繈锝炴径灞稿亾闂堟稑鎮戞繛鐓庣箻瀹曟粏顦撮柍绗哄€濆缁樻媴閸涘﹤鏆堢紓浣割儐閸ㄥ潡骞冨ú顏勎╅柍鍝勫€告禍妤呮⒑閸涘﹤濮﹂柛鐘愁殜閹繝宕橀鑲╅獓闂佺粯鍔栧ḿ娆撍夌€n偁浜滈柨鏃囧亹閻g敻鏌″畝瀣?闁逞屽墾缁插宕濆畝鍕劦妞ゆ帊鑳舵晶顒傜磼瀹€鍐摵缂佺粯绻堝畷鍫曟嚋閸偅鐝栭梻鍌欑窔濞佳呮崲閹烘挻鍙忛梻鍫熺▓閺嬫柨鈹戦悩宕囶暡闁抽攱鍨块幃褰掑炊閿濆倸浜鹃柧蹇e亞娴滆埖淇婇悙顏勨偓鎴﹀礉瀹€鍕亱闁规崘宕靛畵浣割熆閼搁潧濮囩紒鐘电帛閵囧嫰寮崶褌姹楀銈忛檮濠㈡﹢鈥旈崘顔嘉ч柛鈩冾殔濞兼垿姊虹粙娆惧剱闁圭ǹ顭锋俊鐢稿礋椤栨稒娅嗛柣鐔哥懃鐎氼參鎮甸弴鐘电=濞达綀娅g敮娑氱磼鐎n偅宕岄柛鈹惧亾濡炪倖甯婇懗鍫曞煀閺囩偟鏆嗛柨婵嗘噺閸嬨儵鏌熼姘辩劯濠碘€崇埣瀹曘儵濡堕崶銊ユ畬濡ゆ浜欓崡鍐茬暦閻旂⒈鏁囬柣姗€娼х敮銊╂⒒閸屾瑦绁版い鏇熺墵瀹曟澘螖閸涱厾锛熼梺瑙勫劶婵倝宕戦埡鍛叆闁绘柨鎼牎闂佺粯甯婄划娆撳蓟閵娾晛绫嶉柛銉厛濡嫮绱撻崒姘偓褰掑箲閸パ屾綎缂備焦岣块悷褰掓煃瑜滈崜鐔煎春閳ь剚銇勯幒鎴濃偓鍛婄濠婂牊鐓犳繛鑼额嚙閻忥繝鏌¢崨顓犲煟妤犵偞锕㈤、娆撴偩鐏炶棄濡囬梻鍌欒兌绾爼宕滃┑鍠㈠搫饪伴崨顖滃箵闂佸搫鍟崐鐢稿磻閹炬枼鏋旈柛顭戝枟閻濐噣姊洪棃鈺冪Ф缂佽弓绮欓幃楣冩倻閼恒儱浜楅柟鐓庣摠钃遍柡鍌楀亾闂傚倷绀佹竟濠囧磻閹烘纾婚柛娑卞枟濞呭繑绻濋悽闈浶ユい锝庡枤濡叉劙寮撮姀鐘碉紱闂佺鎻粻鎴犲瑜版帗鐓涚€规搩鍠栭懟顖炲疾閻樺磭绡€闁汇垽娼ф牎闂佽偐鎳撴晶鑺ョ珶閺囩喓绡€婵﹩鍘鹃崢鐢告⒑閸涘﹥瀵欓柛娑卞幘椤愬ジ姊绘担铏瑰笡闁规瓕顕х叅闁绘梻鍘ч拑鐔兼煥閻斿搫孝缂佲偓閸愵喗鐓ユ繝闈涙閸gǹ顭跨憴鍕婵﹤鎼晥闁搞儜鍛Ф闂備礁澹婇悡鍫熺椤忓牆鏄ラ柍褜鍓氶妵鍕箳瀹ュ浂妲繝鈷€灞界仭缂佺粯鐩畷妤呮嚃閳轰讲鍚傞梻浣哥枃椤宕归崸妤€绠栭柍鍝勫暊閸嬫捇宕烽鐐愩垺銇勯妷锔剧畼缂佽鲸甯¢幃娆擃敆閳ь剟宕濋妶澶嬬厱婵﹩鍓﹂崕鏃€顨ラ悙鑼ⅵ濠碘剝鎮傛俊鐑筋敊閽樺绱﹂梻鍌欒兌绾爼宕滃┑瀣ㄢ偓鍐川鐎电ǹ绁﹂柣搴秵閸犳鍩涢幋鐘电<閻庯綆鍋掗崕銉╂煕鎼淬垹濮嶉柡宀€鍠栭幃鐑芥偋閸繃鐏庨梻浣虹帛娓氭宕抽敐鍜佸殨濞寸姴顑呮儫闂佹寧娲嶉崑鎾淬亜鎼淬垺宕屾慨濠冩そ瀹曘劍绻濋崟顓犵獥闂備胶枪濮橈箑鐣烽棃娴筹綁骞囬柇锔芥櫓闁诲繐绻戦悧妤呭棘閳ь剟姊绘担鐟邦嚋缂佸鍨归埀顒佸嚬閸撴氨绮嬮幒鎴斿牚闁告洍鏅欑花濠氭⒑閻熸壆鎽犵紒璇插暣瀹曞疇銇愰幒鎿冩⒖婵犮垼鍩栭崝鏍偂閻斿吋鐓欓弶鍫濆⒔閸掓壆鎮鑸碘拺缂佸鐏濋銏°亜閵娿儻韬€殿喛顕ч埥澶愬閻橀潧濮堕梻浣告啞閸斞呯磽濮樺崬鍨濆┑鐘崇閳锋垿姊洪銈呬粶闁兼椿鍨遍弲鍫曨敍閻愭潙浠哄銈嗙墬缁嬫垵霉椤曗偓閺屻劌鈹戦崼婵呯捕闂佸疇顫夐崹褰掑焵椤掑﹦绉甸柛瀣噹閳诲秴饪伴崼鐔叉嫼闂佸憡绋戦敃锝囨闁秵鐓曢柟鎯ь嚟閹冲洭鎸婇悢鍛婂弿婵妫楅崢鎾煛閳ь剚绂掔€n亞顔婇梺瑙勫劶濡嫮澹曠憴鍕箚闁靛牆瀚崝宥夋煕濞嗗繒绠婚柡宀嬬秮楠炲鏁愰崱鈺傤棄缂備胶鍋撻崕鎶解€﹂悜钘夎摕闁挎繂顦粻娑欍亜閺冨倸甯跺┑鈩冩そ濮婅櫣绮欏▎鎯у壈濡炪倖鍨甸ˇ闈涱嚕婵犳碍鏅查柛娑樺€婚崰鏍箠閿熺姴围闁糕剝鑹鹃崡鎶芥⒒閸屾瑧绐旈柍褜鍓涢崑娑㈡嚐椤栫偛鍌ㄩ柛婵勫劤绾惧ジ鏌ら梹鎰シ濠㈣蓱閵囧嫰寮撮鍡櫺滃Δ鐘靛仦閿曘垽銆佸▎鎴濇瀳閺夊牄鍔庣粔閬嶆⒒閸屾瑧鍔嶉柡瀣偢瀵彃鈽夐姀鐘垫焾濡炪倖鐗滈崑鐐哄磻閻斿吋鐓涢柛銉e劚閻忣亪鏌嶉柨瀣瑨闂囧鏌ㄥ┑鍡欏妞ゃ儱顦遍幃顔碱潩閼哥鎷洪梺鍦瑰ù鐑姐€傞弻銉︾厪闁搞儜鍐句純闂佽桨绀侀崐濠氬箯閻樿鐭楀璺哄婢规洜绱撻崒姘偓宄懊归崶銊d粓缂佸顕冲☉銏犵妞ゎ厽鍨靛▓銊╂⒑閸︻叀妾搁柛鐘崇墵閿濈偤宕ㄧ€涙ḿ鍘撻梻浣诡儥閸ㄧ増绂嶆ィ鍐┾拺鐟滅増甯╁Λ鎴犵磼椤曞懎鐏i柟骞垮灩閳藉鈻庨幇顔拘ら梻浣告啞閹稿棝宕ㄩ崨顔垮闁宠鍨块幃娆撳矗婢跺﹦褰呯紓鍌氬€哥粔鎶芥倿閿旂晫鈹嶅┑鐘插閸嬫挸鈽夊▎瀣窗缂備讲妾ч崑鎾绘⒒娴h鍋犻柛搴灦瀹曟繃鎯旈妸銉ュ亶闂備緡鍓欑粔鐢稿煕閹达附鍋℃繛鍡楃箰椤忊晠鏌涢弬璇测偓鏍Φ閸曨垰鍗抽柕濞垮劚缁犺崵绱撴笟鍥ф灈妞ゎ厾鍏橀獮鍐ㄢ枎閹炬潙鈧粯淇婇婊冨付妤犵偛绉垫穱濠囨倷椤忓嫧鍋撻弽褜娼栧┑鐘宠壘绾惧鏌熼崜褏甯涢柛濠傛健閺岀喓绮欑捄銊︽婵炲瓨绮嶇划鎾诲蓟閵娾晛鍗虫俊銈傚亾濞存粌澧界槐鎾诲磼濮樻瘷銏ゆ煥閺囥劋绨绘い鏇稻缁绘繂顫濋鐐扮盎缂備胶鍋撴刊鑺ャ仈閹间礁鐤炬い鎺嗗亾闁宠鍨块、娆戞喆閹烘洦娼愮紒鍌氱Ч椤㈡宕熼銈庢Х婵$偑鍊栭悧妤咁敋闁秴绫嶉柛顐ゅ枎娴滃綊姊婚崒姘卞缂佸鍔曢埢浠嬵敂閸″繐浜鹃柛蹇擃槸娴滈箖姊洪幐搴g畵闁绘锕﹀☉鐢告嚋閸忓摜绠氶梺鍛婄懃椤︻垱鎱ㄥ鍡╂闁绘劖娼欏ù顔筋殽閻愯宸ラ柣锝囧厴瀹曟儼顦抽柣蹇庣窔濮婅櫣鎷犻垾铏亞闂佸憡顨嗘繛濠傜暦鐟欏嫨鍋呴柛鎰╁妿椤ρ囨⒑閸涘﹣绶遍柛娆忛铻炴繝濠傜墛閳锋帡鏌涚仦鍓ф噮妞わ讣绠戦…鍧楁偡鐢喛鍚梺璇″櫙缁绘繂鐣锋總绋课ㄩ柕澹秶骞㈤梻鍌欒兌绾爼宕滃┑瀣仭鐟滃海绮欐径濠庡悑闁告稑鍊瑰Λ鍐极閹版澘宸濇い鎾跺枑椤斿姊绘担铏瑰笡闁圭ǹ顭烽幃鐑藉煛閸涱厾鐣哄┑掳鍊曢幊蹇涘磻閵娾晜鐓熺憸鎴︻敋瑜忕槐鐐寸節閸屾粍娈惧┑鐘诧工閻楀棛娑甸埀顒勬⒑鐠囪尙绠烘い鏇嗗懐绀婂┑鐘叉搐缁犳牠鏌嶉埡浣告殲闁稿海鍠栭弻鏇$疀婵犲啯鐝曢梺鎸庣☉濡繂顫忕紒妯诲闁告稑锕ラ崕鎾绘⒑濞茶澧柕鍫⑶归悾閿嬪閺夋垹鐤€濡炪倖鍨奸崑鎰娴煎瓨顥婃い鎰╁灪婢跺嫮绱掔€n偄鐏╃紒顔肩墦瀹曞ジ濮€閳ヨ櫕鐎鹃梻濠庡亜濞诧妇绮欓幋婢囧蓟閵夛妇鍘藉┑鈽嗗灥閸嬫劗鏁☉銏$厓闂佸灝顑呴悘锔剧磼缂佹ḿ娲撮柟宕囧У閿涙劕鈹戦崱姗嗗敳濠德板€楁慨鐑藉磻閻愭亽鈧啴宕卞☉妯滐箓鏌涢弴銊ョ仩閹喖姊洪棃娑辨▓闁搞劎鏁诲畷銉╊敃閿旇В鎷洪柣鐘叉礌閳ь剝娅曢悵顖滅磽娴h櫣甯涚紒璇茬墦婵″瓨绗熼埀顒€顕i幘顔碱潊闁斥晛鍟悵鏍⒒娓氣偓閳ь剛鍋涢懟顖涙櫠閹绢喗鐓欐い鏃傛櫕閹冲嫮绱掔紒妯肩疄鐎规洖鐖兼俊姝岊槻閻㈩垱鍎抽埞鎴︽偐閸偅姣勯梺绋库看閸ㄥ爼宕洪埀顒併亜閹烘垵顏╃痪鎯ь煼閺岀喖鎮欓浣轰紘闂佽 鍋撻柤鎭掑劘娴滄粓鏌¢崒姘变虎闁诡喗鍨块弻娑㈡偐閹存劖鍨块獮鍫ュΩ閿斿墽鐦堥梺鍛婁緱閸n喗绂掗埡鍐=濞达絼绮欓崫娲偨椤栨稑绗╅柣蹇斿浮閺岋綁鎮╅崣澶嬫倷閻庢鍠涘▔娑㈠煝閹炬椿鏁冮柨鏃囆掗幏缁樼箾鏉堝墽鍒伴柟璇х節楠炲绮欐惔鎾存杸濡炪倖姊婚崑鎾诲汲椤掑嫭鐓欐い鏂诲妼濞诧箓宕戦幇顔瑰亾閻熸澘顥忛柛鐘崇墪閳绘捇濡搁敂鍓х槇闂佹眹鍨藉ḿ褎鐗庣紓浣哄亾濠㈡ḿ绮旈悷閭﹀殨闁哄被鍎辩粻鐟懊归敐鍛础闁告ǹ妫勯埞鎴﹀煡閸℃浠╅梺璇茬箲缁诲牓骞嗛崘顭嬫椽顢旈崨顖氬汲婵犵數鍋為崹鍫曟偡瑜旈幆灞剧節閸ャ劎鍘撻柣鐔哥懃鐎氼剟鎮樼€涙ǜ浜滈柕蹇ョ磿閹冲洭鏌熼姘辩劯妞ゃ垺娲熼、鏇㈠焺閸愨晛闂梻鍌欑窔濞佳兠洪敃鍌氱闁哄诞灞芥闂佸憡娲﹂崹鎵不濞戞瑣浜滈柟鎹愭硾閺嬪酣鏌涢弮鈧敮鈥愁潖濞差亝鍋¢柡澶嬪閸婎垶姊烘导娆戠У濞存粠浜滈悾宄扳攽閸♀晛鎮戞繝銏f硾閿曪箓宕㈤柆宥嗏拺缁绢厼鎳忚ぐ褔姊婚崟顐㈩伃鐎规洘鍨块弫鎰緞鐎n剙骞堥梻渚€娼чˇ浠嬪垂閸愯尙鏆嗘繛鎴欏灪閻撴洟鎮楅敐搴′簼鐎规洖鐭傞弻鐔兼偂鎼达絿楔濡炪們鍨哄ú鐔镐繆閸洖绀嬫い鎺嗗亾闁哄鍊濆濠氬磼濮橆兘鍋撻幖浣哥9闁绘垼濮ら崐鍧楁煥閺囩偛鈧摜绮婚弽顓熺厱妞ゆ劧绲剧粈鈧紓浣插亾濠㈣埖鍔栭崐鍫曟煟閹邦喗鏆╂繛澶堝灮缁辨捇宕掑☉妯烘懙闂佸搫鑻粔瑙勪繆閻戣姤鏅濋柍褜鍓氶弲鍫曨敍閻愬鍘遍梺闈涚墕濡瑧绮堥埀顒勬⒑鐎圭媭娼愰柛銊ユ健楠炲啴鍩℃担鐑樻闂佹悶鍎撮崺鏍р枔瑜版帗鈷掑ù锝呮啞閹牓鏌熼崘鑼妤犵偛鍟村畷鎺楁倷閼艰埖鎲伴梻浣瑰缁诲倿骞夊鈧幃銏ゆ偂鎼存繄鐐婇梻浣告啞濞诧箓宕i崘顔藉仒闁瑰墽绮埛鎺戙€掑锝呬壕濠电偘鍖犻崗鐘虫そ閺佸倿鎮欓鈧惔濠囨⒑閸涘﹤濮﹀ù婊勭箓閻g兘宕f径宀€顔曢梺鐟邦嚟閸嬬喖骞婇崟顓犵=鐎广儱鎳忛崰姗€鏌$仦鍓ф创妤犵偞锚铻栭柍褜鍓涢埀顒佸嚬閸撴氨绮嬮幒鏇樹汗闁圭儤鎸撮幏娲⒑閸涘﹦绠撻悗姘卞厴瀹曟洖鈽夊Ο蹇曟嚀楗増鎯斿┑瀣粣闁诲孩顔栭崰娑㈩敋瑜旈、妯荤附缁嬪灝绐涘銈嗙墬缁嬫帡鎮块崒鐐粹拻闁稿本鐟х拹浼存煕濞嗗繒绠崇紒顔碱煼楠炲鏁冮埀顒傜矆閸儲鍋eΔ锕侊骏閳ь兘鍋撻梺琛″亾闁兼亽鍎禍婊堟煛閸愩劌鈧爼鍩€椤掆偓椤戝棜鐏嬪┑顔斤供閸樺墽绮绘ィ鍐╃厱婵犲﹤鍟弳鐔虹磼婢舵ê鏋熸い銊e劦閹瑩鎳犻鍌ゅ晪闂備浇顕栭崰鎺楀疾濠靛绠柣妯肩帛閸ゆ垶銇勯幋锝嗙《缂佲偓閸儲鈷掗柛灞剧懅閸斿秹鏌涙惔鈥虫毐闂囧鎱ㄥΟ鎸庣【缁炬儳顭烽弻娑㈠焺閸愶紕绱板銈傛櫆閻擄繝寮诲☉銏╂晝闁挎繂妫涢ˇ銊╂⒑閹惰姤鏁遍悽顖涘浮濠€渚€姊洪幐搴g畵婵炶绠撳畷鐢稿焵椤掆偓椤啴濡堕崱妯碱槰缂備緡鍠栫粔鍫曞箲閵忕姭妲堥柕蹇曞Х椤斿矂姊洪崷顓炲妺婵﹤顭烽、娆撳箳濡や礁鈧敻鎮峰▎蹇擃仾缂佲偓婢跺浜滄い鎰╁焺濡茶櫣绱掗纰卞剶妤犵偞甯″顒勫传閸曨亜顥氶梻浣瑰缁诲倹顨ラ崨濠冩珷妞ゆ柨澧界壕鐓庛€掑顒婂姛闁伙絽鐏氶幈銊︾節閸愨斂浠㈤悗瑙勬磸閸斿秶鎹㈠┑瀣<婵ê鍚嬬紞鍡涙⒒閸屾瑧顦﹂柟璇х節瀵濡搁埞褍娲Λ鍐ㄢ槈閸楃偞顓块梻浣告啞缁嬫垿鏁冮妷鈺佺?闁绘柨鍚嬮悡蹇撯攽閻樿尙绠版い鈺婂墴閺屾稑螣閸忓吋姣堥梺鍝勭焿缁查箖骞嗛弮鍫熸櫜闁糕剝蓱閻﹀酣姊洪崫鍕靛剾濞存粍绮撳﹢渚€姊虹紒妯忣亞澹曢銏″剹鐎光偓閸曨剛鍘介梺闈涱樈閸犳洜鑺遍悾宀€纾奸弶鍫涘妼濞搭喖鈹戦鐟颁壕闂備胶绮敋闁告埃鍋撳┑鈩冾殕閹瑰洤顫忕紒妯诲闁告稑锕ラ崕鎾寸節閵忥絾纭炬繛宸幖閻e嘲饪伴崘锝嗘杸闂佺硶妾ч弲娑樷枔椤愶附鈷戦柛娑橈攻婢跺嫰鏌涘Ο鐑樻儓闁宠绮欓、鏃堝醇閻斿搫骞嶉梺璇插缁嬫帡鏁嬬紓浣诡殕瀹€鎼佸蓟濞戙垹鐓涢柛灞惧濡插牓姊虹€圭媭娼愰柛銊ユ健楠炲啴鍩¢崪浣规櫇闂佹寧绻傞幏瀣焵椤掆偓缁绘ê顫忓ú顏勫窛濠电姴鍟伴ˇ銉╂⒑鐠囪尙绠茬€光偓閹间礁绠栭柟绋挎捣閻熷綊鏌嶈閸撴瑩锝炶箛娑欐優閻熸瑥瀚悵浼存⒑閻愯棄鍔氱痪缁㈠幗缁傛帡鍩¢崨顔规嫼缂傚倷鐒﹂敃鈺佲枔閺囥垺鐓曢柡鍐e亾妞ゃ劌鐗撳畷姘跺箳閺冣偓鐎氭碍绻涢弶鎴剱妞ゎ偄绉撮埞鎴﹀煡閸℃浠搁梺琛″亾闂侇剙绋勭紞鏍偓骞垮劚閹冲寮ㄦ禒瀣厽闁归偊鍓欑痪褎銇勯妷锔剧煉闁哄矉绻濆畷濂割敃閵忕媭娼鹃梻渚€鈧偛鑻晶顖毲庨崶褎鎯堥摶鐐烘煕閺囥劌鐏犻柣鎾达耿閺岀喐娼忔ィ鍐╊€嶉梺绋匡功閸忔﹢寮婚妶澶婄濞达綀顫夐柨顓炩攽閻愭潙姣嗛柛娑卞灣閿涙繈姊虹粙鎸庢拱婵ǜ鍔忛埅鐢告⒒娴e懙褰掝敄閸℃稑绠伴柟闂寸閻撴﹢鏌熸潏鍓х暠闁绘搫绻濋弻娑㈠焺閸愶缚娌紓浣靛妼椤兘寮婚敐鍡樺劅闁靛繈鍩勯弳鈥斥攽閻橆喖鐏柨鏇樺灲楠炲啯銈i崘鈺佲偓濠氭煢濡尨绱氶柕濞炬櫆閻撳繐鈹戦悩鑼閻庨潧鍚嬮幈銊ф喆閸曞灚鐤佸┑顔硷攻濡炶棄鐣烽悜绛嬫晣闁绘劖褰冮‖鍡涙⒒娴g瓔娼愰柟顔煎€荤划濠氬冀瑜忛弳锕傛煏韫囧鈧牠鎮為懖鈹惧亾楠炲灝鍔氭俊顐㈢焸楠炲繘鎼归崷顓狅紳闂佺ǹ鏈悷褔宕濆澶嬬厓缂佹鎼埀顒佺箞閵嗕線寮崼婵嬪敹濠电娀娼ч悧濠囨倿妤e啯鈷掑ù锝呮啞鐠愶繝寮搁鍫熷€垫繛鎴炲笚濞呭﹦鈧娲╃紞鈧紒鐘崇洴楠炴瑩宕橀鍕毄闂傚倷绀侀崥瀣箖閸屾盃缂氱憸搴ㄥ箞閵娾晛閱囬柕澶涘閸樹粙姊虹憴鍕姢妞ゆ洦鍙冮獮濠囧礋椤戝彞绨婚梺闈涒康缁蹭粙宕濋敃鍌涚厵妞ゆ梻鏅幊鍥煙瀹曞洤鈻堟い銏$墵閹虫顢涘☉鎵佸亾濡ゅ懏鈷掗柛灞剧懄缁佺増銇勯弴鍡楁噺瀹曞弶淇婇妶鍛殨闁绘帒锕ョ换娑㈠幢濡纰嶉梺缁樺笒閻忔岸濡甸崟顖氱闁瑰瓨绻冮悘鎾斥攽閻愭彃鎮戦柛鏃€鐗滈幑銏犫槈閵忕姷鐓戞繝銏f硾閼活垶鍩涚仦鍓х瘈缁剧増菤閸嬫挸鐣烽崶褏鍘介柣搴ゎ潐濞插繘宕濆鍥ㄥ床婵犻潧娲︽刊鎾煣韫囨挻璐¢柡鍡曞嵆濮婂宕掑▎鎺戝帯缂備緡鍣崹璺虹暦瑜版帗鍋傛鐑嗗墯閻╊垰鐣烽悢纰辨晝闁挎繂妫欓鍥⒒閸屾艾鈧悂宕愭搴㈩偨婵﹩鍏楃紓姘辨喐閺冨牆围妞ゅ繐鐗婇崑銊╂煕濞戞☉鍫ュ箰閸愵喗鈷戦柛娑橈攻婢跺嫰鏌涢妸銈呭祮闁诡喖娼¢、娆撴偩瀹€鈧鏇㈡倵閻熸澘顥忛柛鐘虫礈閼鸿鲸绺介崨濠勫帗闂備礁鐏濋鍛归鈧弻锛勪沪閸撗佲偓鎺懨归悪鍛暤鐎规洘绮忛ˇ鎶芥煕閿濆骸鐏︽慨濠呮缁瑧鎹勯妸褜鍞堕梻浣规た閸撴繈宕戦幇顑╋綁骞囬弶璺唺濠德板€曢敃銉╁疾椤忓牊鈷戦柛娑橈梗缁堕亶鏌涘Ο鐓庝壕缂佸倹甯¢崺鈩冪瑹閸ャ劌鐦滈梻渚€娼ч悧鍡橆殽閸涘﹦顩叉繝濠傛噽绾捐偐绱撴担濮戭亪鎮橀埡鍛厵妤犵偛鐏濋悘鈺呮煃鐟欏嫬鐏寸€规洟浜堕崺锟犲磼濮橆剙甯繝纰夌磿閸嬫垿宕愰弽褜鍟呭┑鐘宠壘绾惧鏌熼崜褏甯涢柣鎾存礋閹鏁愭惔婵堟晼闁轰礁鐗撳铏规嫚閳ヨ櫕鐏堥梺鎼炲灪閻擄繝濡堕鍛嚤闁哄鍨归ˇ鏉款渻閵堝棗绗掗柛濠勄归锝夊箮閼恒儮鎷绘繛杈剧秮椤ユ挻绋夐懠顒傜<闂婎偒鍘鹃惌娆戔偓瑙勬礃閻撯€愁嚕婵犳艾唯闁靛/鍐ㄧ闂備胶鎳撻崥瀣偩椤忓牆绀夌€光偓閳ь剛鍒掔紒妯肩瘈婵﹩鍘鹃崢鍛婄節閵忥絾纭炬い鎴濇嚇閹﹢鏁愰崱妯哄伎闁荤喐鐟ョ€氬嘲鈻撳⿰鍕弿濠电姴瀚敮娑㈡煙瀹勭増鍤囬柟鐓庣秺閹兘骞嶉鍛还闂傚倸鍊风粈渚€骞夐垾鎰佹綎鐟滅増甯楅崑瀣煟濡灝鐨洪柡鍡畵閺岋綁鎮㈢粙娆炬闂佽 鍋撳ù鐘差儐閻撴洘銇勯幇闈涘闁告帗澹嗘禍姝岀疀閹绢垱鏂€闂佺粯锚閻忔岸寮抽埡浣叉斀妞ゆ梻鍋撻弳鈺呮煕閻樿宸ユい鎾冲悑瀵板嫭绻濋崟顐㈢疄闂傚倷鑳堕、濠囧箵椤忓牊鈷旈柛鏇ㄥ灠绾惧鏌嶉埡浣告殶缂佺娀绠栭弻娑㈠焺閸愮偓鐣肩紓浣哄Х婢ф濡甸崟顔剧杸濠电姴鍟悵鏇㈡⒑闂堟稒鎼愰悗姘卞娣囧﹪鎮滈懞銉︽珖闂侀€炲苯澧柟渚垮妼椤撳吋寰勭€n剙骞愰柣搴″帨閸嬫捇鎮楅敐搴″闁伙箑鐗撻幃妤冩喆閸曨剛锛橀梺鍛婃⒐閸ㄥ潡濡存担绯曟瀻闁圭偓娼欓埀顒勬敱閵囧嫰骞掗崱妞惧闂備焦鎮堕崝鎴炵鐠轰警娼栫紓浣股戞刊瀵哥磼濞戞﹩鍎忔繛鍫熷姍濮婃椽宕妷銉愶絾銇勯妸銉含鐎殿噮鍋婂畷姗€顢欑喊杈ㄧ秱闂備線娼ч悧鍡涘箠韫囨拹锝夘敆閸曨兘鎷洪梺鍝勫€堕崕鎻掆枍閸涘瓨鐓曢柣鏇氱閻忥繝鏌涢幒鎴含妤犵偞锕㈤、娆撴偩鐏炶棄绠炲┑鐘垫暩閸嬫稑螞濡も偓闇夋慨姗嗗劦閿濆牄浜归柟鐑樻尵閸樺憡绻濋姀锝嗙【闁挎洏鍎靛畷顖炴倷閻剙閰e畷鎯邦檪闂婎剦鍓熼弻鐔碱敊閻e本鍣板銈冨灪濡啫鐣烽悢鐓幬╅柕澶堝€曢ˉ姘舵⒒娴e憡鎯堢紒瀣╃窔閹ê鈽夊Ο閿嬵潔濠电偛妫欓崝鏇㈩敁閹剧粯鐓熼柣鏂挎憸閹冲啴鎮楀鐓庡妞ゆ洩缍佸畷绋课旀担鍙夊闂傚倸鍊搁悧濠勭矙閹惧瓨娅犻柡鍥╁枔缁犻箖鎮橀悙鎻掆偓鍛婃叏閸岀偞鐓欐い鏍ㄦ皑閻掑摜鈧娲栧畷顒勫煡婢跺ň鏋庨柟瀛樼箓缁楁岸姊洪懡銈呮瀾缂侇喖绉堕崚鎺楀箻瀹曞洦娈惧┑鐘诧工閻楀﹪宕戦崟顐熸斀闁稿本鍑瑰Σ鍦磽瀹ュ懘鍙勬慨濠冩そ楠炲棜顦寸紒鐘卞嵆閺屾稑螣閼姐倗鐓夐悗瑙勬礃閸ㄥ潡鐛Ο鍏煎珰闁告瑥顦粊鑸典繆閻愵亜鈧牠骞愭ィ鍐ㄧ?闁圭増婢橀悞鍨亜閹哄棗浜鹃梺鍝勭墱閸撴盯骞戦姀鐘闁靛繒濮烽ˇ褔姊虹紒妯诲碍濡ょ姵鎮傞敐鐐哄箳濡や讲鎷洪梺鍛婄箓鐎氼厼锕㈡导瀛樼厽闁冲搫锕ら悘鈥城庨崶褝韬鐐寸墬閹峰懘鎳栧┑鍕闁哄被鍔戝鏉懳旈埀顒佺閻愵剛绠鹃悗鐢登规牎濠电偛鍚嬮悷銊╂倶閸愵喗鈷戠紓浣癸公閼版寧绻涙担鍐插椤╅攱绻濇繝鍌滃闁绘挻娲熼弻锝夊棘閹稿骸鏆堥柣蹇撻獜婵″洭鍩€椤掑喚娼愭繛鍙壝—鍐╃鐎n亝鐎梺鐟板⒔缁垶宕戦幇鐗堢厱婵炲棗娴氬Σ璺好归悩顔肩仼闁宠鍨块幃娆撴嚋闂堟稒閿紓鍌氬€哥粔顕€宕戦幘鎰佹富闁靛牆楠告禍婊勩亜閿旇鐏﹂柛鈹垮灩椤撳吋寰勬繝鍕偓鐐烘⒑闂堟胆褰掑磹濡ゅ啰涓嶆慨妯垮煐閳锋垹绱撴担濮戭亝鎱ㄩ敃鈧湁婵犲﹤瀚惌鎺楁煕閳规儳浜炬俊鐐€栭崹鍫曞磿閹惰棄鐒垫い鎺嶈兌缁犳捇鏌i敐鍥у幋妤犵偛顑夐弫鍐焵椤掑倻涓嶉柧蹇e亗缁诲棝鏌曢崼婵嗏偓鍛婄妤e啯鈷戠紒瀣劵椤箓鏌涢弬璺ㄧ劯闁糕晝鍋ら獮瀣晝閳ь剛澹曢崗鑲╃闁瑰鍋熼幊鍛磼婢跺孩鐝紒缁樼箞婵偓闁挎繂妫涢妴鎰斿Δ濠佺凹婵炲吋鐟ラ悳濠氬锤濡も偓閻撴盯鏌涚仦涔呰偐鑺辨繝姘拺閻熸瑥瀚粈鍐╃箾婢跺鈽夐柡鍡忔櫊濮婄粯鎷呮搴濊缂備胶濮甸崹鍧楀箖瑜旈獮姗€骞囨担鍦▉闂備礁鎲$换鍌溾偓姘嚀椤﹀湱鈧娲橀崕濂杆囬弶鎳ㄥ綊鎮℃惔锝咁暫闂佸疇顫夐崹鍧楀箖濞嗘挸绾ч柛顭戝枤濞堝爼姊绘担鍛婂暈婵炶绠撳畷锝嗘償閳泛缍婂畷鐔碱敍濞戞帗瀚奸梻浣告贡鏋悗娑掓櫇缁牓鍩€椤掑嫭鈷戠紒瀣皡瀹搞儳绱撳鍜冭含妤犵偛鍟撮崹楣冨棘閵夛妇鈧姊洪悷閭﹀殶濠殿喚鍏橀弫宥呪堪閸喓鍘介柟鍏兼儗閸ㄥ磭绮旈悽鍛婄厱閻庯綆鍋勫ù顔锯偓瑙勬礃濞茬喐淇婇悜钘夌厸闁稿本绮岄獮妤呮⒒娴g儤鍤€濠⒀傜矙楠炲﹪骞樼€靛壊娲搁悷婊呭鐢鎮¢崘顏呭枑婵犲﹤鐗嗙粈鍫熺節闂堟侗鍎滅紓宥嗙墪椤法鎹勭悰鈥愁潓闂佸憡绻傜€氣偓闁绘柨鎽滈悷瑙勩亜閺嶃劎鈽夐柣锔界矒濮婄粯鎷呴挊澹捇鏌ㄥ顓滀簻闁挎洖鍊烽幉鍓р偓娈垮枟婵炲﹪寮崒鐐村殟闁靛鍎辨导搴㈢節绾板纾块柛瀣█椤㈡俺顦崇紒鍌氱Ч楠炲棜顧佹繛鎾愁煼閺屾洟宕煎┑鍡樻闂佽娴氭禍顏堝蓟閿濆鍋勯柛娆忣槹閻濇艾螖閻橀潧浠滈柨鏇ㄤ簻椤曪絾绂掔€e灚鏅i梺缁樺姍濞佳囩嵁閹扮増鈷戦悹鍥ㄥ絻閸よ京绱撳鍛棦鐎规洘绮岄埢搴ㄥ箻閺夋垶鐣梻浣侯潒閸曞灚鐣烽梺鎶芥敱鐢繝寮诲☉姘勃闁硅鍔曢ˉ婵嬫⒑闁偛鑻晶瀛樸亜閵夛附灏甸柛鎺撳浮瀹曞ジ鎮㈢粙娆锯偓鎾绘⒒閸屾氨澧愰柡鍛仱閸┾偓妞ゆ巻鍋撴繛灏栤偓鎰佹綎婵炲樊浜堕弫鍡涙煃瑜滈崜娑氬垝閺冨倵鍋撻悽鐧诲綊藟濮橆兘鏀介柣妯虹-椤f煡鏌i幘瀵告噰闁哄瞼鍠撻幉鎾礋椤愨懣鏇㈡⒑閹肩偛鈧牠鎮疯濡叉劙骞掑Δ浣镐汗闂佸憡鍔栬ぐ鍐箺閻㈠憡鈷戦悹鍥b偓铏亶闂佹寧娲忛崹浠嬬嵁閸愩劉鏋庨柟瀵稿Х閿涙繈鏌熼崗鑲╂殬闁搞劎鎳撻湁妞ゆ棃鏁崑鎾斥枔閸喗鐏嶉梺璇″枛閸婃悂顢氶敐澶樻晢闁逞屽墲閻忓姊婚崒姘卞缂佸鎸剧划鏂棵洪鍛幍濡炪倖妫侀~澶娾枍閸涱喓浜滈柡鍌濇硶缁犵粯銇勯姀锛勬噰闁诡喒鍓濋幆鏃堝煡閸℃﹩妫岄梻鍌氬€搁崐鎼佸磹閻戣姤鍤勯柛鎾茬閸ㄦ繃銇勯弽顐粶缂佺姵婢樿灃闁挎繂鎳庨弳娆戠磼閹邦収娈滈柡灞糕偓鎰佸悑閹肩补鈧磭顔愰梻浣芥閸熶即宕伴弽顓炶摕闁挎繂顦Λ姗€鏌涢…鎴濇灍闁稿⿴鍨跺铏圭磼濡櫣鐟愮紓渚囧枟閻熲晛顕f繝姘╅柍杞扮瀹撳棗鈹戞幊閸婃劙宕戦幘瓒佺懓饪伴崼銏㈡毇濠殿喖锕ㄥ▍锝夊箯閻樼粯鍤戞い鎺戝亞閸炲搫鈹戦悩鍨毄闁稿鍔欏畷鎴﹀箻缂佹ǚ鎷洪梺鍛婄箓鐎氼噣鎮炵捄銊х=鐎广儱瀚崝宥吳庨崶褝韬鐐寸墬閹峰懐鎲撮崟顒傚絾婵犵數濮甸鏍窗濡ゅ懎绀夐柟鐑橆殕閹偤骞栧ǎ顒€濡介柣鎾跺枛楠炴牕菐椤掆偓閻掓椽鏌涢悢椋庣闁哄本鐩弫鎰償閳╁啰褰庨柣搴ゎ潐濞叉﹢宕归崜浣瑰床婵犻潧顑呯壕鍏肩節婵犲倸顏い鏃€娲栭埞鎴︽偐缂佹ɑ閿梺绋匡功缁垶鎮樺▎鎾寸厱闁绘垵妫楅悘锔芥叏婵犲啯銇濇鐐村姈閹棃濮€閳哄倵鎸呭┑锛勫亼閸娿倝宕戦崟顖€鍥焼瀹ュ懐鍔﹀銈嗗笂濡炴帗绂嶉姀銈嗙厱閻庯綆鍋勬慨澶嬩繆閸欏濮嶆鐐瘁缚閹风娀鎳犻濠勫簥濠电姷鏁搁崑娑樜涘▎鎾冲瀭闁兼祴鏅濋悳缁樹繆閵堝懏鍣洪柍閿嬪灴閺岀喖鎳栭埡浣风捕婵犲痉銈呬汗闁逞屽墲椤煤閿曞倸绀堟繛鎴欏灩閻鏌涘☉鍗炲箰闁衡偓閼恒儯浜滈柡鍌涱儥濞肩喎霉閻樺磭鐭掗柡灞剧〒閳ь剨缍嗛崑鍛焊閻㈠憡鐓冪憸婊堝礈濮橀鏁婇柡宥庡幖缁愭淇婇妶鍛櫣缁炬儳鐏濋埞鎴﹀磼濠ф捁顫夐、濠囨⒒娴e憡璐″褎顨呴…鍨熼懖鈺€绗夐梺瑙勫劶婵倝鎮″▎鎾寸厵閻熸瑥瀚慨鍫㈢棯椤撶姴浜炬い銊e劦閹瑩鎳犻鈧埅闈涒攽椤旂》榫氭繛鍜冪秮楠炲繘鎮╃拠鑼唽闂佸湱鍎ら崹鍫曟儊閿濆洨纾介柛灞捐壘閳ь剙鎽滅划鏃堝级閹宠櫕绋戦埞鎴﹀幢濞嗘劖顔曢梻浣侯攰閹活亞绮婚幋婵愬晠婵犻潧娲㈡禍婊堟煛瀹ュ啫濡块柟鍐叉嚇閺屾盯骞橀崡鐐差瀳濡炪値浜滈崯瀛樹繆閸洖骞㈡俊顖滃劋濞堫偊姊绘担鍛婃喐濠殿喗娼欒灋婵炲棙鍨归惌澶屸偓骞垮劚閹冲宕奸鍫熺厱闁哄洦顨嗗▍鍐磼閵娿儺鐓兼俊顐㈡嚇椤㈡洟濮€閳ユ剚妲遍梻浣烘嚀閹诧繝骞冮崒鐐偓渚€寮崼婵堝幐闂佸憡渚楅崰姘跺储閹间焦鈷戠紒顖涙礃椤﹪鏌涘鈧粻鏍х暦濮橆厼顕遍悗娑欋缚閸樻捇鏌i悢鍝ユ噧閻庢凹鍓熼幃姗€骞橀鐣屽幈闂侀潧饪电粻鎴﹀礉閵堝鐓熼柨婵嗘搐閸樺鈧娲橀崕濂杆囬幘顔界厱婵☆垰婀遍惌娆撴煛瀹€瀣ɑ闁诡垱妫冩俊鑸垫償閵忋垻啸濠电姷鏁搁崑娑橆嚕閸洘鍋嬮柡鍥ュ灪閸嬧晠鏌i幋鐘垫憘闁轰礁妫濋弻娑㈠箛閸忓摜鑳虹紓浣靛妿閸忔ê顫忔繝姘<婵炲棙鍩堝Σ顕€姊虹涵鍜佸殝缂佺粯绻傞悾宄扳攽鐎n偅娅嗛梺浼欑到閻牆煤缁嬪簱鏀介柣妯肩帛濞懷勩亜閹存繃鍤囨慨濠傤煼椤㈡稑鈽夐弽锔剧泿闂備礁鎼粙渚€宕戦崟顒傤浄闁挎洖鍊归悡鍐⒑閸噮鍎忕紒妤佸浮濡焦寰勯幇顓犲弳濠电娀娼уΛ娆忣啅濠靛鐓欓柦妯侯槸閳ь剙娼″璇测槈閵忕姈褔鏌涢埄鍐噭闁革絼鍗冲铏规嫚閳ヨ櫕鐏嶅銈冨妼閹虫﹢宕洪妷锕€绶為柟閭﹀墰椤斿﹪姊虹憴鍕姢妞ゆ洦鍙€閵囨劗鈧綆鍠楅悡鐔煎箹濞n剙鈧倕岣块幇顓犵闁告瑥顧€閼板潡鏌熼鎯у幋濠碘剝鎮傞崺鈩冩媴閸曞墎鐣甸柡宀€鍠栭幃褔宕奸悢鍝勫殥缂傚倷鑳舵慨鍨箾婵犲洤钃熼柣鏃囥€€閸嬫捇鎮介惂璇茬秺椤㈡挾浠﹂崣銉х畾闂佽壈澹堝▔娑㈡偂閹邦喚纾肩紓浣贯缚缁犵偤鏌熼鑽ょ煓婵☆偄鍟埥澶娢旀担绋款€忛梻鍌氬€风粈浣圭珶婵犲洦鍋傞柛顐犲劚閸ㄥ倿鎮规ウ鎸庮仩闁哄棴濡囬惀顏堫敇閻愭潙娅℃繛瀛樼矊缂嶅﹪寮婚悢鍏煎€绘俊顖濐嚙绾板秹姊洪柅鐐茶嫰婢ь喗绻涚涵椋庣瘈鐎殿喛顕ч埥澶愬煑閳规儳浜鹃柨鏇炲€哥粻锝嗙節闂堟稒鍣介柟绋款槸閳规垿鎮欓懠顒佹喖缂備緡鍠栫粔鍫曞礆閹烘绠婚悹鍥蔼閹芥洟姊虹紒妯烩拻闁告鍕嚤闁绘ḿ绮悡鏇㈡煛閸ャ儱濡奸悽顖樺姂閺屻劌鈹戦崱妯虹獩缂佹儳澧介崢褔婀侀梺鎸庣箓閻楁粌岣块幇顔剧<閻犲搫鎼痪褔鏌曢崶褍顏い銏★耿閸╁嫰宕橀鍌楀亾婵犲洦鈷戦柣鐔告緲缁狙囨煙缁嬪灝鏆遍柣锝囧厴閹垽鎮℃惔陇鈧灝鈹戦埥鍡楃仴婵炲拑绲剧€佃偐浠﹂崜褏鐦堢紒鐐緲椤﹁京澹曢崸妤佺厸濞达絿鐡旈崵娆撴煟閿濆洤鍘撮柟顔哄灮閸犲﹥娼忛妸锔界彨濠电姷鏁搁崑鐐哄垂閸洘鍋¢柨鏇炲€归崑鐔兼煛閸ャ儱鐏柍閿嬪灴閺屻倖鎱ㄩ幇顑藉亾閺囩偟鎽ュ┑鐘垫暩閸嬬偟绮婇幘顔肩柧婵犻潧娲ㄩ々鑼磼鐎n亞姘ㄩ柡瀣叄閺岀喖鏌囬敃鈧▍妯荤箾閺夋垵顏慨濠囩細閵囨劙骞掗幙鍕惞闂備胶绮敮顏嗙不閹捐鏄ユ繛鎴欏灩缁狅綁鏌ㄩ弮鍌涙珪闁告ü绮欏楦裤亹閹烘垳鍠婇梺鎼炲姂娴滄儼妫㈡繝銏e煐閸旀牠鎮¢弴銏$厸闁告劑鍔庢晶娑欑箾閹冲嘲娲﹂悡鍐偡濞嗗繐顏╅柣蹇旀尦閺屾盯濡搁埡鍐毇闂佸湱鍘х紞濠囥€侀弴銏狀潊闁挎稑瀚幃宥嗙節瀵伴攱婢橀埀顒侇殕閹便劑鎮滈挊澶岋紱闂佺粯鍔曢幖顐﹀垂閸岀偞鐓曟い顓熷灥閺嬨倝鏌¢崱顓犵暤闁哄矉缍佸顕€宕掑Δ浣哥彵闂備浇妗ㄧ粈浣虹矓閻㈢ǹ绠為柕濞炬櫆閺呮煡鏌涘☉鍗炵仭闁谎傜窔濮婃椽宕崟顒€娅ф繝鐢靛亹閸嬫捇鎮楀▓鍨灈妞ゎ參鏀辨穱濠囧箹娴e摜鍘告繛杈剧悼鏋紒渚囧枟缁绘繂顕ラ柨瀣凡闁逞屽墯閸旀瑥鐣烽幋锕€绠婚悺鎺嶈兌閹虫捇銈导鏉戠闁靛ǹ鍨虹€垫牜绱撻崒娆愮グ濡炴潙鎽滈弫顕€鍨惧畷鍥ㄦ濠电姴锕ゅΛ顓炍熸担绯曟斀闁挎稑瀚禍楣冩煙椤旂厧鈧灝顕g拠娴嬫闁靛繒濮堥埡鍛厪濠电偛鐏濋埀顒佹礋楠炲棝宕奸妷锔规嫼闂佽崵鍠愭竟鍡涙偩椤撱垺鐓曢柕濞垮劤缁夋椽鏌涢埞鍨姕鐎垫澘瀚伴獮鍥敆婢跺绉遍梻鍌欒兌缁垵鎽銈嗘⒐閻楃姴鐣烽婧惧亾閿濆骸鏋熼柍閿嬪笒闇夐柨婵嗘噺閸熺偤鏌熼姘卞闁靛洤瀚伴弫鍌炲垂椤旇偐銈柣搴ゎ潐濞叉牜绱炴繝鍋芥盯宕橀…瀣秺閹虫粓妫冨☉娆掔檨闁诲氦顫夊ú鏍Χ閸涘﹣绻嗛柣鎴eГ閺呮粓鎮峰▎蹇擃仼妞ゅ繐缍婂濠氬磼濞嗘帒鍘″銈冨灩閿曨亜鐣烽幋锕€绠涢柡澶庢硶閿涙稑鈹戦悙鏉戠仸闁荤喆鍊楅幑銏ゅ幢濡偐顔曢悗鐟板閸犳洜鑺辨總鍛婄厽闁规儳鐡ㄧ粈鍐ㄇ庨崶褝韬┑鈥崇埣瀹曟帒顫濋銏╂闂傚倸鍊风粈渚€骞楀⿰鍫濈獥閹肩补妾紓姘舵煥閻斿搫孝缂佺姵鐗犻弻鐔碱敍閸℃鍣烘繛鍫熺箞濮婇缚銇愰幒鎾撮敪闂佸摜鍠庡ḿ锟犲箖瑜嶉~婵嬫嚋绾版ɑ瀚奸梻浣告啞缁嬫垿鏁冮妷锕€绶為柛鏇ㄥ灡閻撴洟鏌熼幆褜鍤熼柕鍡樺笧缁辨帡顢欓懞銉閻庤娲栭妶绋款嚕閹绢喗鍋勯柛娆忣槸椤忓綊姊婚崒娆戭槮闁硅绻濆畷婵嬪即閻戝棗娈ㄩ梺鍓插亝濞叉牜绮诲鑸电厱妞ゆ劗濮撮崝婊堟煟閹惧瓨绀嬮柡宀嬬秮瀵噣宕堕妸褋鈧劙鎮楃憴鍕碍婵☆偅绻堝濠氬焺閸愨晛顎撻梺鍛婄缚閸庢盯濮€閵堝棛鍘撻柣鐔哥懃鐎氼剟鎮橀埡鍛厓鐟滄粓宕滈妸褏绀婇柛鈩冪☉绾惧鏌嶈閸撶喖寮婚悢鍏煎仾妞ゆ牗渚楁禒鈺冪磽娴d粙鍝洪柟绋款煼楠炲繘宕ㄩ弶鎴狀槶闂佸湱绮敮鎺撶珶婢舵劖鈷戦悹鍥у级閹癸綁鏌i悢绋库枙鐎规洘锕㈤幊妤咁敍濡も偓娴滈箖鏌涜椤ㄥ棝鎮¢悢闀愮箚闁靛牆鍊告禍楣冩⒑缂佹﹩娈旈柨鏇ㄤ簻閻g兘鏁愰崼銏㈡澑闂佸搫鍊告晶鐣岀不濮橆剦娓婚柕鍫濇婢ь剛绱掗妸銊ゅ惈闁瑰弶鎸冲畷鐔碱敆閳ь剙顕i崸妤佲拺闂侇偆鍋涢懟顖涙櫠鐎涙ɑ鍙忓┑鐘插暞閵囨繃顨ラ悙鍙夊闁瑰嘲鎳忛ˇ鐗堟償閵忊剝顏i梻鍌氬€峰ù鍥ь浖閵娿儍褰掑炊椤掑鏅悷婊勬閺佹劙鎮欓崜浣烘澑闂佸搫娲ㄦ慨鐑芥晬濠婂啠鏀介柍钘夋閻忋儲銇勯弴鍡楁祩閺佷線鏌熼崜褏甯涢柍閿嬪灴閺屾稑鈽夊鍫濆濠电偞褰冮悺銊ф崲濞戞瑦濯撮柛鎰级閸g晫绱掗埀顒佺節閸屾鏂€闂佺粯锚瀵爼宕掗妸鈺傜厓鐟滄粓宕楀☉姘偨婵﹩鍓﹂崵鏇灻归悩宸剾闁轰礁娲弻锝夊箛椤栨俺鏁块梺閫炲苯澧柣蹇旂箞閸╃偤骞嬮敂钘夆偓鐑芥煛婢跺鐏╁ù鐘叉憸閳ь剙鍘滈崑鎾绘煥濠靛棙鍣洪柛瀣ㄥ劜閵囧嫰濮€閿涘嫭鍣悗鍨緲鐎氫即鐛崶顒夋晣婵炴垶鐟ラ褰掓⒒閸屾瑨鍏屾い銏狅躬瀹曟垿骞囬弶璺紱濠电偞鍨崹鍦矆婢舵劖鐓冪憸婊堝礈閻旂厧钃熼柨婵嗙墢閻も偓闂佸搫娲ㄩ崑妯煎垝閼哥數绡€闁冲皝鍋撻柛娑卞枟閻濐亞绱撴笟鍥ф灍闁荤噦绠撻獮蹇涘川鐎涙ɑ鍎梺闈╁瘜閸欏繒妲愰幎鑺モ拻濞达絽鎳欒ぐ鎺戝珘妞ゆ帒瀚崵灞轿旈敐鍛殭闁绘帒鐏氶妵鍕箳閹存績鍋撻幖浣稿偍闁圭虎鍠楅悡娆愩亜閺冣偓閸庤櫕绂掗柆宥嗙厸濞达絿枪閺嗙偤鏌熷畡鐗堝櫧闁瑰弶鎸冲畷鐔碱敃閿濆簼娌繝鐢靛Х閺佸憡鎱ㄩ悜钘夋瀬闁告稑锕ラ崣蹇涙煟閵忕姴顥忛柡浣革躬閺屸€愁吋鎼粹€崇闂佹悶鍔岄崐鍨潖濞差亶鏁嗛柍褜鍓涚划鏃傗偓闈涙憸娑撳秴霉閻撳海鎽犻柣鎾寸懇閺岀喖顢涘⿰鍐炬毉濡炪們鍎遍ˇ鐢稿蓟閿曞倸绀冩い蹇撳閻忓牓姊洪崫鍕潶闁告柨鐭傞崺鐐哄箣閿曗偓楠炪垽鏌嶉崫鍕偓鎰樄婵﹨娅g划娆忊枎閹冨闂佽瀛╅惌顕€宕¢崘宸殨濠电姵纰嶉弲鎻掝熆鐠虹尨鍔熸い鏃€甯¢幃妤冩喆閸曨剛顦ュ┑鐐茬湴閸婃繂鐣烽悽鍓叉晢闁告洦鍏橀幏娲⒑閸涘﹦缂氶柛搴″船閻☆參姊绘担鐟邦嚋婵炶闄勭粋宥呪堪閸剛绋忛棅顐㈡处閹峰煤椤忓秵鏅滈梺鍛婃处閸欏酣宕崶顒佲拻濞达綀娅g敮娑㈡煕閺冣偓閻楁粎鍒掓繝鍥х妞ゆ棁鍋愰敍娑㈡⒑鐟欏嫬绀冩い鏇嗗洤纭€闁规儼濮ら悡蹇涚叓閸パ嶆敾婵炲懎妫濋弻锟犲川椤栨矮妲愬┑顔硷攻濡炰粙鐛弽顓熷€烽柟缁樺笒椤酣姊绘担鍛婃儓闁瑰啿绻掗崚鎺楀箻缂佹ɑ娅滈梺缁樺姇閹碱偊宕¢幎鑺ョ厪闊洢鍎崇壕鍧楁煕濡吋鏆慨濠呮閹风娀鍨惧畷鍥e亾婵犳碍鐓曟繛鎴濆船閺嬬喖鏌涢悩宕囧ⅹ闁宠鍨块幃鈺呭箛娴e憡娅涢梻浣规偠閸旀垶绂嶉崼鏇犲祦闁圭増婢樼粻顕€鏌﹀Ο渚Ъ闁硅姤娲栭埞鎴︽倷閺夋垹浠ч梺鎼炲妼濠€杈╁垝缂佹ḿ绡€婵﹩鍘鹃崢鍛婄節閵忥絾纭炬い鎴濇嚇閹﹢鍩¢崘顏嗭紲婵炶揪绲介幖顐﹀储鐎涙ɑ鍙忓┑鐘插暞閵囨繄鈧娲忛崝宥囨崲濠靛绀冮柕濞у秶澶勫┑鐘垫暩閸嬫盯鎮洪妸褍鍨濋煫鍥ㄦ尨閺嬫牗绻涢幋顓熺窙缂傚秵鐗犻悡顐﹀炊閵婏箑顎涘┑鐐叉▕娴滃爼寮崒鐐寸厱闁哄洢鍔屽楣冩煕閻旈攱鍠樻慨濠勭帛閹峰懘鎼归悷鎵偧闂備礁鎲″褰掓偋閻愬搫桅闁圭増婢樼粈鍐┿亜閺傚灝甯ㄩ柛瀣崌瀵粙顢橀悙鍝勬暪闂備胶绮Λ浣糕枍閿濆鍎婇柛顐犲劜閳锋垿鏌涢幇顖氱毢婵炲牓浜堕弻娑氣偓锝庡亝瀹曞矂鏌$仦鍓ф创妤犵偛娲俊鎼佹晜閻e苯绲鹃梺璇叉唉椤煤閺嶎偄顥氭い鎾跺У椤洟鏌熼幆褏鎽犲┑顖涙綑闇夐柣妯烘▕閸庡繘鏌熼悾灞炬毈婵﹥妞藉畷鐑筋敇閻旈攱鐣繝鐢靛仜濡﹪宕i崘顔肩畺濞村吋鎯岄弫濠囨煕閵忕媭妲洪柛鐘虫尰缁傚秹骞栨担绋垮敤閻熸粌鏈粩鐔煎即閵忊檧鎷婚梺绋挎湰濮樸劍鏅跺☉姘辩<閻庯綆鍋勯悘鎾寠閻旇偐鍙撻柛銉e妽閳锋帞绱掗悩鑽ょ暫闁哄备鍓濆鍕偓锝庝簽娴犳潙顪冮妶鍛闁告瑥鍟村濠氬灳瀹曞洦娈曢柣搴秵閸撴稖鎽梻鍌欐祰椤曟牠宕归崡鐐嶆盯宕橀琛″亾娴g硶妲堟俊顖氬槻閻楁岸姊洪崨濠勨槈闁归攱鍨瑰濠囧礈瑜庡畷鍙夌箾閹寸偛鐒归柛瀣尭閳藉鈻庣€n剛绐楅梻浣规た閸樺ジ鎯岄崒鐐茶摕婵炴垶鍩冮崑鎾绘晲閸愩劌顬堥梺閫炲苯澧紒璇茬墦閹即顢氶埀顒€鐣烽崡鐐╂婵せ鍋撻柛鐐茬埣濮婃椽妫冨☉杈ㄐら梺绋垮婵炲﹨妫熼梺鍝勵槹椤戞瑥銆掓繝姘厪闁割偅绻冮ˉ鐘差熆瑜滈崜娑氭閹烘柡鍋撻敐搴濈敖濠⒀嶉檮椤ㄣ儵鎮欓懠顒傤啋闂佸湱鍘х紞濠傜暦閻戠瓔鏁囬柣娆忔噽闂傤垱绻濋悽闈涗哗闁规椿浜炲濠囨嚍閵壯呭骄婵犵數濮村ú銈囧閸ф鐓欓柟娈垮枛椤eジ鏌涙繝鍕毄缂佽鲸甯掕灃濞达綀銆€濡插牓姊洪崫銉バi柣鈺婂灦楠炲﹪骞樼拠鏌ユ暅濠德板€撻懗鍫曞储闂堟稈鏀介柣鎰皺婢ф洟鏌h箛鏃傜疄鐎殿喗鎮傛俊鍫曞炊閳哄偊绱¢梻浣筋嚃閸ㄥ酣宕橀埡浣插亾椤栫偞鈷戦梻鍫熺⊕閹兼劙鎮楀顓熺凡妞ゆ洩缍侀、妤呭磼濞戞ɑ娅濋梻渚€娼ч悧鍡涘箠瀹ュ绀嗛柟鐑橆殕閳锋帒霉閿濆懏鍟為柛鐔哄仱閺岋綁鎮㈤弶鎴濆Б闂侀€炲苯澧柣顓у櫍瀹曪繝宕樺顔兼婵犵數濮电喊宥夊磻閸曨厾妫柟宄扮焸閸濇椽鏌¢崪浣烽偗婵﹥妞介弻鍛存倷閼艰泛顏繝鈷€鍕棆缂佽鲸甯¢、娆戝枈鏉堚晛鎮戦柣搴㈩問閸犳洜鍒掑▎鎾扁偓浣割潨閳ь剟骞冨▎鎾村仺闁割煈鍋嗛埀顒夊枛閳规垿鎮╅崹顐f瘎婵犳鍠楅幐鎶藉极閸愵喖围濠㈣泛顑呮禍杈ㄧ節閻㈤潧孝婵炲眰鍊楁竟鏇熺節濮橆厾鍘繝鐢靛仧閸嬫挸鈻嶉崱娑欑厽闁规崘娉涢弸娑㈡煛鐏炵偓绀夌紒鐘崇〒閳ь剨缍嗘禍鐐寸妤e啯鈷戦柛婵嗗椤ユ垿鏌¢崨顔剧煁缂佸矁椴哥换婵嬪炊瑜忛宀勬⒑閸︻厼鍔嬮柟鍛婃倐瀵悂鎮╁ù瀣杸濡炪倖姊婚妴瀣礉閻旇櫣纾兼い鏇炴噹閻忥絿绱掗鍛籍闁诡喓鍨介幃鈩冩償閿濆懎袝濠碉紕鍋戦崐鏍ь啅婵犳艾纾婚柟鎯х-閺嗗棝鏌ㄥ┑鍡欏闁告柨鐏氶妵鍕晝娴e湱褰ч梺闈涙搐鐎氱増淇婇幖浣规櫜闁告侗鍘艰缂傚倸鍊烽懗鑸垫叏閻㈠憡鍎庢い鏍ㄥ嚬閸ゆ洟鏌熺紒銏犳灍闁稿﹦鍏橀弻锝夊閵忊剝姣勯梺纭呮閺堫剛鎹㈠┑瀣仺闂傚牊绋愮划璺侯渻閵堝棙澶勯柛妯圭矙楠炲牓濡搁埡浣侯啋濡炪倖娲栭幊蹇涘疾閻愮儤鈷戠紒顖涙礀婢ц尙绱掔€n偄鐏╁瑙勬礃缁绘繂顫濋鐘插箞闁诲骸鍘滈崑鎾绘煃瑜滈崜鐔风暦閹达附鍊烽柣鎴灻禍妤€鈹戦悙鍙夘棡闁圭ǹ顭烽幃鈥斥枎閹邦喚顔曢梺鍓插亝缁诲嫭绂掗姀銈嗙厸閻庯綆鍋嗛埊鏇㈡煏閸パ冾伃闁轰焦鍔欏畷銊╊敃椤厼鍨濋梻鍌欑閹碱偊鎯屾径宀€绀婂〒姘e亾闁绘侗鍠栬灒閻忓繑鐗曟禍鐐箾閹寸偟鎲界紓鍌涚閵囧嫰鏁傞崹顔肩ギ濠殿喖锕ュ钘夌暦椤愶箑绀嬫い鎾跺Т婵晫绱撻崒娆掑厡缂侇噮鍨抽幑銏ゅ磼閻愭潙浠奸悗鐟板閸嬪﹤岣块妸鈺傜厓鐟滄粓宕滈悢濂夊殨妞ゆ劧绠戠粻娑㈡煛婢跺﹦浠㈢紒鎰☉椤啴濡堕崱妤€娼戦梺绋款儐閹稿濡甸崟顖毼ㄩ柨鏇氱椤ユ繈姊虹€圭媭娼愰柛銊ユ健楠炲啴鍩¢崨顓炵€銈嗗姧缁查箖鎯佹惔銊︹拻濞达絽鎳欒ぐ鎺濇晞闁糕剝鐟ч惌娆撴煙鏉堟儳鐦滈柡浣割儔閺屻劌鈹戦崱鈺傂︾紓浣插亾闁割偅绶疯ぐ鎺撴櫜闁搞倛妫勭紞濠囧箖濡崵绡€闁搞儯鍔庨崢鐢告⒑缁嬭法绠洪柛瀣姍瀵啿顫滈埀顒勫蓟濞戙垹妫橀悹鎭掑妿娴煎洨绱撴笟鍥ф灈闁绘鎸搁悾鐑藉础閻愨晜顫嶅┑鐐叉閸ㄧ敻鐛澶嬧拻濞达綀娅g敮娑㈡煕閵婏箑鍔堕柟绛嬪亰閺岋綀绠涢幘鍓侇唺闂佽桨绀侀幗婊兾i幇鏉跨婵°倐鍋撻柣鎾卞灲閺屽秷顧侀柛鎾跺枎閻g兘骞嬮敃鈧粻濠氭倵闂堟稒鎲搁柣锕€鐗嗛埞鎴︽倷閼碱剙顣洪梺璇茬箲缁诲牆顕i幖浣瑰亜闁稿繗鍋愰崣鍡涙⒑閸濆嫭澶勬い銊ユ閳诲秵绻濋崟銊ヤ壕閻熸瑥瀚粈鍐╃箾閼碱剙鏋涙鐐插暣閹儳鐣濋埀顒勬儗濞嗘挻鍋i柛銉墯閺嗘粓鏌¢崨顖氣枅鐎殿喛顕ч鍏煎緞婵犱胶鐐婇梻浣告啞濞诧箓宕戦埀顒勬煕鐎n偅灏扮紒缁樼箓椤繈顢楅埀顒勫磻瀹ュ鈷戦柣鐔告緲閳锋梻绱掗鍛仸闁糕晜鐩獮瀣晜閻e苯骞堟繝鐢靛仦閸ㄥ爼鏁冮锕€绀夐柣鏃囨绾惧ジ鏌eΟ鎸庣彧鐎规洖鐭傞弻鐔碱敊缁涘鐣跺銈庡亝缁诲牓骞冮埄鍐╁劅闁抽敮鍋撻柟濂夊亰濮婄粯鎷呴搹骞库偓濠囨煛閸屾瑧绐旂€规洘鍨块獮姗€骞囨担鐟扮槣闂備線娼ч悧鍡椢涘Δ鍛敜濠电姴娲﹂悡鏇㈡倵閿濆骸浜濋悘蹇庡嵆閺屾洟宕惰椤忣厽銇勯姀鈽呰€块柟顔界懇瀹曪絾绔熼娑欐珚婵﹦鍎ょ€电厧鈻庨幋鐐蹭还闂備胶枪缁绘垼鎽梺閫涚┒閸旀垿宕洪埀顒併亜閹烘垵顏柣鎾崇箻閺屾盯顢曢敐鍥╃暫濡炪們鍎茬划宀勬箒闂佺粯枪濞呮洟濡靛┑鍥ㄥ弿濠电姴鍊归幆鍫ュ极閸儲鐓曢柕澶嬪灥閹冲秶妲愰弴銏♀拻濞达綀濮ら妴鍐煟閹虹偟鐣垫鐐插暣瀹曟帡鎮欓崣澶屸偓顒勬倵楠炲灝鍔氶柟鍐差樀瀵劍绂掔€n偆鍘遍梺闈涱槶閸ㄥ搫鈻嶉崶銊d簻闁哄啠鍋撴繛鑼枛瀵鍩勯崘銊х獮婵犵數濮寸€氼剟銆傞悜妯肩瘈闁冲皝鍋撻柛灞剧矌閻撴捇鎮楃憴鍕鐎光偓缁嬫鍤曢悹楦裤€€閺嬪酣鏌涢幘妤€鍟弳鈺呮⒒閸屾瑦绁扮€规洜鏁诲畷鐗堟償閵忊€冲妳濠电姴锕ら悧蹇涘矗閺囩喆浜滈柟鐑樺灥閳ь剛鏁诲畷鎴﹀箻閼搁潧鏋傞梺鍛婃处閸撴盯藝閵娿儮鏀介柣鎰絻缁狙呯磼鐠囨彃顏柛鎺撳笧閹风姴霉鐎n偒娼旈梻渚€娼х换鎺撴叏閻戣姤鍎撻柛鏇ㄥ灡閳锋垹绱掔€n偄顕滄繝鈧幍顔剧<妞ゆ梹鍎抽埢鍫⑩偓瑙勬处閸ㄩ亶骞嗛弮鍫熸櫜闁搞儮鏅槐鍐测攽閻愯埖褰х紓宥勮兌缁辨挸顫濋澶屸偓鍫曟煙闂傚鍔嶉柣鎾存礃缁绘盯宕卞Δ鍐唶闂佸搫妫寸紞渚€骞愭繝鍥ㄥ亜闁稿繗鍋愰崢鐢告⒑绾拋娼愰柛鏃€鐗滃☉鐢稿箚瑜夐弨鑺ャ亜閺囩偞鍣瑰褎鎸抽弻锛勪沪閻e睗銉︺亜瑜岀欢姘跺蓟濞戙垹绠婚悗闈涙啞閸d即姊洪悙钘夊姕婵☆偄鍟悾宄邦潨閳ь剟銆佸▎鎾冲簥濠㈣鍨板ú锕傛偂閺囥垺鐓欓柟浣冩珪濞呭懎鈹戦垾宕囦虎闂囧鏌eΟ鍨惞闁伙絿鍎ら幈銊︾節閸愨斂浠㈤梺璇″枤閸忔﹢骞冭瀹曠厧鈹戦崶銊ф毉闂傚倸鍊烽懗鍫曞磿閻㈢ǹ绀堟繝闈涙灩濞差亝鍋勯柣鎾虫捣閻e搫鈹戦濮愪粶闁稿鎸鹃埀顒冾潐濞叉﹢鏁冮姀銈呮槬闁跨喓濮寸粈鍐┿亜韫囨挾孝闁哄拋鍙冨缁樻媴閸涘﹥鍎撳銈忓瘜閸ㄥ爼骞冭瀹曞崬螣缂佹ḿ褰垮┑鐐差嚟婵挳顢栭崨顖滅焼闁糕剝顦鸿ぐ鎺撳亗閹艰揪绲鹃幉濂告⒑缂佹ɑ灏版繛鍙夛耿楠炲牓濡搁妷顔藉缓闂佸壊鍋侀崹褰掑春鐏炲墽绠鹃悗娑欋缚閻﹤顭胯閺咁偄危閹版澘绠婚悹鍥皺閿涙粌鈹戦悙鍙夘棡闁圭ǹ顭烽、鎾诲冀椤撶啿鎷洪梺鍛婄☉閿曘儵鎮¢妷鈺傜厽妞ゆ挾鍋涢埀顒€娼″畷瑙勩偅閸愨晜娅囬梺绋挎湰缁嬫垿鍩€椤掆偓椤兘寮婚敃鈧灒濞撴凹鍨辨瓏闂備胶顢婃慨銈吤洪悢濂夋綎闁惧繐婀辩壕鍏间繆椤栨粌鍔﹂柟宄邦煼濮婃椽宕ㄦ繝搴e姸闂佸憡渚楅崹鎶芥倿婵傚憡鈷戠紒瀣硶閻忛亶鏌涚€n剙浠遍柟顕嗙節閹晛鐣烽崶鈺婂晭闂備礁鎼ˇ浼村春閸儱纾块柟閭﹀幘缁犻箖鏌涘☉鍗炲箺妞ゃ儳鍋熺槐鎺旂磼濡吋鍒涢悗瑙勬礀閵堟悂銆侀弴銏狀潊闁绘﹩鍋呯€氼剙鈹戦悩鎰佸晱闁哥姵鐗犻弫鍐Ψ閵夘喗瀵屾繛瀵稿Т椤戝洤鐣垫笟鈧弻鈥愁吋鎼粹€崇闂佺ǹ锕﹂崗姗€寮婚悢铏圭<婵☆垵妗ㄩ崚濠囨⒑鐠囨彃顒㈠┑鐐诧工椤繒绱掑Ο璇差€撻梺鍛婄☉閿曘劎娑甸埀顒勬⒒娴gǹ鏆遍柛銏$叀閹囧箻瀹曞洦娈鹃梺鐟邦嚟閸嬬喓寮ч埀顒勬⒑閹肩偛鍔€闁告侗鍨卞В鍥⒒閸屾瑦绁版い鏇熺墵瀹曡鎯旈妸銉ョ獩濡炪倖姊婚弲顐﹀级濞差亝鈷掗柛灞剧懄缁佺増銇勯銏╂█妞ゃ垺鐟╁浠嬵敇閻愮數宕舵繝寰锋澘鈧劙宕戦幘缁樼厓缂備焦蓱瀹曞瞼鈧鍠楅幐铏叏閳ь剟鏌嶉柨顖氫壕闂佸綊鏀卞钘夘潖濞差亜宸濆┑鐘插濡插牓姊洪幐搴㈢8闁稿孩褰冮銉╁礋椤栨氨顦板銈嗙墬缁嬫捇宕㈤柆宥嗏拺閻熸瑥瀚崝銈嗐亜閺囥劌骞栭悡銈夋倵閻㈢數銆婇柛瀣尵閹叉挳宕熼鍌︾喘闂備焦鎮堕崝瀣垝濞嗘挻鍋樻い鏇楀亾鐎殿喕绮欐俊鎼佹晝閳ь剟顢撻幘缁樷拺闁煎鍊曢弸鎴濐熆閻熼偊鍎旂€规洘鍨块獮妯肩磼濡桨缂撻梻浣告啞缁嬫垿鏁冮敃鍌氬偍闂侇剙绉甸ˉ濠冦亜閹扳晛鐏璺哄閺岀喓浜搁弽銊︾彅闁告浜槐鎺斺偓锝庡亾缁扁晠鏌i悢绋款棎闁割偒浜弻娑㈩敃閻樿尙浼勯梺鍝勬-閸嬪﹤顫忓ú顏勪紶闁告洦鍘鹃崝鍦磽娴e湱鍙€缂佺姵鐗犻悰顕€宕卞☉妯肩潉闂佸壊鍋掗崑鍛村疾椤掆偓閳规垿鎮╃拠褍浼愰梺鐟板级閻╊垶寮幇顓炵窞閻庯急鍕伖闂傚倷绀侀幉锛勭矙閹达附鏅濋柕澹倻鍓ㄩ梺瑙勵問閸犳氨澹曟總鍛婂€甸柨婵嗛娴滅偛顭胯閺佸寮诲☉銏犵厸濞达絿鎳撳▓妤呮⒑鐠団€虫灆缂侇喗鐟ラ悾鐑藉Ω閿斿墽顔曢梺缁樺姦閸撴瑩顢斿ú顏呪拻闁稿本鐟ㄩ崗宀勫几椤忓牊鐓涢柛顐亜婢ф挳鏌熼鎯у幋濠碘剝鎮傞崺鈩冩媴娓氼垱袧闂佽楠搁崢婊堝磻閹剧粯鐓冪憸婊堝礈閻旂厧绠氶柍褜鍓氶妵鍕疀閹捐泛鈷堥梺杞扮濞差參寮婚敐澶婄疀闁绘鐗婇柨顓㈡⒑缂佹ɑ灏甸柛鐘崇墵楠炲啫螖閳ь剟鍩㈤幘璇插瀭妞ゆ梻鏅禍鍫曟⒒娴h櫣甯涢柟纰卞亞閹广垹鈹戠€n€儱銆掑锝呬壕閻庢鍣崳锝呯暦閻撳簶鏀介柛鈩冨焹閸嬫捇宕归瑙勬杸闂佸疇妫勫Λ妤呮倶閻樼粯鐓欑痪鏉垮船娴滅偤鏌ゅú顏冩喚濠碉紕鍏橀弫鍌炲礈瑜忓Σ鍥⒒娴e湱婀介柛銊ㄦ宀h儻顦归柛鈹垮灲瀹曞ジ鎮㈤搹璇″晭濠电偠鎻徊浠嬪疮閸ф瑙︽俊顖濄€€濡插牊淇婇鐐存暠妞ゎ偄绉瑰娲濞戞氨顔婃繝娈垮枛閻忔艾岣胯箛娑橀唶闁靛鑵归幏娲⒑閸︻厐鍦偓娑掓櫊閸╂盯骞囬悧鍫㈠幈闂侀潧饪垫俊鍥╃不濮椻偓閺岀喖鐛崹顔句紙閻庤娲栧畷顒勫煡婢跺ň鏋庨柟瀛樼箓婵″洭姊婚崒娆戭槮濠㈢懓锕畷鎴﹀川椤栨稑搴婇梺鍛婂姦閸犳牠姊婚娑氱鐎瑰壊鍠曠花濂告煟閹惧瓨绀嬮柡灞诲妼閳规垿宕卞鍡橈紒闂備線娼уú锔炬崲閸儱钃熼柍銉ョ-閺嗗棝鎮楅敐搴″闁伙箑鐗撻幃妤冩喆閸曨剛锛橀梺鍛婃⒐閸ㄥ潡濡存担绯曟瀻闁规儳纾ˇ顓㈡偡濠婂啰绠荤€殿喛鍩栫粋鎺斺偓锝庡亐閹风粯绻涙潏鍓у埌闁硅绻濋獮鍡涘醇閵夛妇鍘惧┑鐐跺蔼椤曆囨倶閿濆洨纾兼い鏃囧Г椤ュ牓鏌熼鐣岀煉闁哄睙鍥ㄥ殝妞ゆ巻鍋撳┑锛勬櫕缁辨帒螖閸愩劍鐏堥梺绯曟杹閸嬫挸顪冮妶鍡楃瑨閻庢凹鍓熼幏鎴︽偄閸濄儳顔曢梺鐟扮摠閻熴儵鎮橀埡鍐<闁绘ê妯婇悡濂告煙椤旂瓔娈滅€规洖缍婇、鏇㈡晲閸涱剙鎽嬮梻鍌欑窔閳ь剛鍋涢懟顖涙櫠椤栫偞鍋ㄦい鏍ㄤ緱濞堟洜绱掑畝鍐摵缂佺粯绻堝畷鎯邦槾闁绘挻鍨剁换婵嬪閿濆棛銆愰梺鎸庢磸閸婃繈鏁愰悙鍝勭婵°倓璁查幏娲煟閻樺弶绀岄柍褜鍓濆▍鏇㈡倶瀹ュ鈷戦柤濮愬€曢弳鈧梺鎼炲劀閸涱厼袝濠碉紕鍋戦崐鏍暜閹烘柡鍋撳鐓庡箹闁宠棄顦抽ˇ褰掓煛瀹€鈧崰鏍箠閻愬搫唯鐟滃繘鎮℃径鎰拺閻犲洠鈧磭浠х紓浣藉煐閼归箖鎮鹃柨瀣檮缂佸顕抽妸鈺傜叆闁哄啫娴傚ḿ鎰版倵濮樺啿浜圭紒杈ㄦ崌瀹曟帒鈻庨幋顓熜滄俊鐐€栭崹闈浳涘☉銏犵劦妞ゆ帒鍊婚幊妤呮煕閹邦垰鍔甸柍褜鍓欏ḿ锟犲蓟閻斿皝鏋旈柛顭戝枟閻忔挾绱掗悙顒€鍔ら柛姘儔婵$敻宕熼姘辩潉闂佹悶鍎滈崒娑氭綎闂佽瀛╃粙鎺旀崲閸繍娼栭柛婵嗗閺嗭箓鏌涢妷銏℃珔缂佹绻濆娲捶椤撯偓瑜版巻鈧箓鏌ㄧ€b晝绠氶梺鍓插亝濞叉﹢寮查幓鎺濈唵閻犺櫣灏ㄩ崝鐔搞亜閿斿搫濮傛慨濠冩そ瀹曟﹢宕f径搴n攨闂備胶枪椤戝棝骞愭ィ鍐ㄧ劦妞ゆ帊娴囨竟姗€鏌曢崼鈶跺綊锝炶箛鏇犵<婵☆垵顕ч鎾绘⒑閸涘﹦鈽夐柨鏇樺妿濞戠敻鍩€椤掑嫭鈷戦柛婵嗗閸庢稑霉濠婂嫮绠橀柟骞垮灩閳藉濮€閻樻鍟嬫俊鐐€栧ú鏍箠韫囨蛋澶愬冀椤愩倗锛濇繛鎾磋壘濞层倝寮稿☉娆嶄簻妞ゆ挾濮撮崢鎾煟濞戝崬鏋涢摶锝夋煠濞村娅囬柨娑欑矊閳规垿鍩ラ崱妤冧化闂佸憡顭嗛崶鈺佺ウ濠德板€撻懗鍓佸姬閳ь剟鎮楅崗绋垮祮闁衡偓閸楃儐鐔嗘慨妞诲亾闁糕斁鍋撳銈嗗笂閻掞箑鐣峰畝鍕厵闁惧浚鍋掑▓婊呪偓瑙勬礀閵堢ǹ顕i幘顔藉亜鐎瑰嫭婢橀ˉ妤佺節閻㈤潧啸闁轰礁鎲¢幈銊╁级閹炽劍妞芥俊鍫曞炊閵娿儱骞戦梻渚€鈧偛鑻晶瀛樻叏婵犲啯銇濈€规洏鍔嶇换婵囨償閵忋垺姣夐梻鍌欒兌鏋い鎴濇瀹曟繂鈻庤箛锝呮闂侀潧饪垫俊鍥€呴悜鑺ュ€甸柨婵嗛娴滅偤鏌涘Ο鎸庮棄闁宠鍨块崺銉╁幢濡ゅ啩娣繝鐢靛仜閹锋垹绱炴笟鈧顐㈩吋閸滀礁鎮戦梺绯曞墲閸旀帞鑺辨繝姘拺闁圭ǹ娴风粻鎾翠繆椤愶絿娲寸€规洩缍侀崺鈧い鎺戝閳锋垿鏌涘┑鍡楊伂閻庢碍澹嗙槐鎺撳緞婵犲嫮楔閻庢鍠栭…閿嬩繆濮濆矈妲烽梺绋款儐閹瑰洭寮幇顓熷劅婵犻潧鐗婇弲鐓庘攽閻愬樊鍤熷┑顔芥尦婵″墎绮欏▎鐐稁濠电偛妯婃禍婵嬫倿婵犳碍鐓熼柟閭﹀灠閽勫ジ鎮楀顓熺凡妞ゎ叀鍎婚ˇ鑼偓娈垮枛閻栧吋淇婇悽绋跨妞ゆ牭绲鹃弲婵嬫⒑闂堟稓绠氶柡鍛矌閻熝囨⒒娴h櫣甯涢柟绋跨埣瀹曟劕鈹戠€n亣鎽曢梺鐐藉劜閸撴岸宕ョ€n喖绠归弶鍫濆⒔鐎靛吋鎱ㄧ憴鍕垫當闁宠鍨块幃娆撳矗婢跺棙鐏嗗┑鐐茬摠缁秶鍒掑澶婄?妞ゆ劧闄勯悡鐔兼煟閺傛寧鎲搁柣顓烇躬濮婅櫣鏁鎯у煂濡炪倖娲╃紞浣哥暦濡ソ鍦偓锝庝簽婢ь垶姊绘担鍛婂暈婵炶绠撳畷銏°偅閸愮偓鏅╅梺鍝勬储閸ㄦ椽鍩涢幋锔界厽闁绘梻鍘ф禍浼存煕閵堝洤鏋涢柡灞剧〒閳ь剨缍嗛崜娆撳几濞戞瑯娈介柣鎰嚋閺€濠氭煙瀹勭増鍤囬柟鐓庣秺瀹曠兘顢橀妸褍绨ラ梻鍌欐祰瀹曞灚鎱ㄩ弶鎳ㄦ椽濡堕崪浣告闂佸壊鍋呭▔娆愬緞閹邦厼鈧兘鏌i幋鐐ㄧ細闁告﹩浜娲箹閻愭彃濡ч梺鍛婂姇瑜扮偟妲愰弮鈧穱濠囧Χ閸ヮ灝銉╂煕鐎n偆鈽夐悡銈嗐亜閹惧崬鐏╅柡鍕╁劦閺屽秹鍩℃担鍛婃婵犳鍨遍幐鍐差嚕閸洘鍊烽梻鍫熶緱閺嗩參姊虹粙娆惧剰闁硅櫕锚椤繑绻濆顒傦紲濠电偛妫欓崺鍫澪i鈧娲捶椤撴稒瀚涢梺绋款儏鐎氼垶鎮樼€n亖鏀介柣鎰级椤ョ偤鏌熺粙娆剧吋鐎规洘鍨块弫鎾绘偐瀹曞洤寮抽梻浣告惈濞层劑宕戝☉銏犵劦妞ゆ巻鍋撻柟璇х節閵嗕焦绻濋崶銊㈡嫽婵炶揪绲介幉锟犲疮閻愬绠鹃悹鍥囧懐鏆ら悗瑙勬礉椤鈧潧銈稿鍫曞箣閻欌偓閺€銊╂⒒娴g懓鍔ゆ繛瀛樺哺瀹曟垶鎷呴崷顓ф锤濠电姴锕ら悧蹇涘矗閹剧粯鐓曢柕澶涚到婵′粙鎮樿箛鏇烆暭闁靛洤瀚版俊鐤槻閸熸悂姊虹拠鈥虫珮闁革綇缍佸顐﹀磼閻愯尙顓洪梺鍦劋濮婂鎮炬ィ鍐┾拻濞撴埃鍋撴繛浣冲洦鍋嬮柛鈩冾樅濞差亜围闁告侗鍠楅惁搴ㄦ⒒閸屾艾鈧兘鎳楅懜鐢典粴婵$偑鍊栭崹闈浢洪鐐垫殾闁硅揪绠戝洿婵犮垼娉涢敃銉╂倵椤掑嫭鈷戦柛娑橈工婵箓鏌涢悩宕囧⒌闁挎繄鍋ゅ畷銊р偓娑欋缚閸橆亪姊洪崜鎻掍簼缂佽鍊垮铏節閸ャ劎鍘遍柣搴秵閸嬪懐浜告导瀛樼厵鐎瑰嫮澧楅崳浠嬫煕閺嶃劎澧电€殿喗鎸抽幃銏㈡偘閳ュ厖澹曟繝鐢靛У绾板秹鍩涢幋锔界厱闁挎棁顕ч獮鏍瑰⿰鍛壕缂佺粯鐩畷妤呮嚃閳哄倸娅氶梻浣筋嚃閸ㄤ即宕愰崹顔炬殾闁绘梻鈷堥弫鍡涙煕鐏炲墽鐭屾俊鎻掓喘濮婄粯绗熼埀顒€岣胯椤ㄣ儴绠涢弴鐐电瓘闂佸憡鎸嗛崟顐㈠箲闂備胶绮崝锕傚礂濞戞碍宕查柛鈩兦滄禍婊堟煙閺夊灝顣崇紒澶婄仛缁绘盯宕奸悢鍝ヮ槶缂備浇椴哥敮鈥崇暦閹烘埈娼╂慨锝嗙懕缂嶄線寮婚弴銏犻唶妞ゆ帒鍊昏ⅵ闁诲氦顫夊ú姗€鏁冮姀銈呮槬闁跨喓濮寸粈鍐煏婵炲灝鍔ゆい鏃€鍨垮濠氬磼濮橆兘鍋撻悜鑺ュ殑闁割偅娲忛埀顑跨劍缁绘繈宕惰椤斿苯顪冮妶鍛婵☆偅顨堝▎銏ゅΧ婢跺鍘辨繝鐢靛Т鐎氼剙鈻嶈箛娑欑厸闁糕剝绋愰幉鐐叏婵犲偆鐓肩€规洘甯掗埢搴ㄥ箳閹存繂鑵愮紓鍌氬€风欢锟犲闯椤曗偓瀹曞綊宕奸弴鐘茬ウ闂佸綊鍋婇崰妤冣偓姘哺閹攱鎷呮搴″濠碉紕鍋樼划娆撶嵁閸愵喖顫呴柕鍫濇噽椤ρ囨⒑缂佹ɑ灏紒銊ㄥ亹閼洪亶宕归锛勭畾闂佺粯鍔︽禍婊堝焵椤掍胶澧电€规洘绻嗛ˇ瀵哥磼椤旂⒈鐓兼鐐差儔閺佸倿鎸婃径鍡椾壕鐎瑰嫭澹嬮弨浠嬫煟濡搫绾у璺哄閺岋綁骞樺畷鍥╊唶闂佸疇顫夐崹鍧楀箖閳哄懏鍤戞い鎺戝亞閸炴椽姊绘担椋庝覆缂傚秳鐒︾粋宥囨崉娓氼垱缍庣紓鍌欑劍閿氱紒鍓佸仜閳规垿鎮╅幓鎺斿絽閻熸粌閰i獮鍫ュΩ閿斿墽鐦堥梺鍛婂姀閺傚倹绂掗姀銈嗏拺閻犲洠鈧櫕鐏撻梺绋跨箲閿氭い鏇秮瀹曟粍鎷呴悷鎵紡闂備線娼ц墝闁哄懏绻傞悾宄扳堪閸啿鎷婚梺绋挎湰閻燂妇绮婇悧鍫涗簻闁哄洨鍠撴晶鐢碘偓瑙勬磻閸楀啿顕f禒瀣垫晣闁绘劗顣槐顕€姊绘担绋款棌闁绘挸鐗撳畷鎶筋敋閳ь剙鐣烽悽绋垮嵆闁绘劏鏅滈弬鈧梻浣虹帛閿氱痪缁㈠弮閵嗗倿寮婚妷锔惧幐闂佸憡渚楅崰鏍緤缂佹ǜ浜滄い鎾跺仦閸嬨儵鏌熼搹顐ょ煉闁诡垰顦甸、鏃堝川椤撶姳绱濋柣搴㈩問閸犳鎮¢敓鐘叉瀬闁归偊鍘肩欢鐐烘倵閿涘崬瀚鍦磽閸屾艾鈧悂宕愰悜鑺ュ€块柨鏇氱劍閹冲瞼绱撴担鍝勪壕闁稿孩濞婇垾锕傛倻閽樺鎽曢梺鎸庣箓椤︻垳绮婚幎鑺ョ厽闁归偊鍠楅弳鈺呮煛閸℃劕鈧繂顫忛搹瑙勫珰闁炽儴娅曢悘宥夋煟鎼达絿鎳楅柛銉戝拋鍞甸梻浣告啞娓氭宕归幍顔瑰亾閸偆鍙€闁哄矉绻濆畷鍫曞煛娴e湱鈧箖姊洪崫鍕垫Ц闁规祴鍓濈粚杈ㄧ節閸ャ劌鈧攱銇勮箛鎾愁仱闁稿鎹囧鍊燁檨婵炲吋鐗曢埞鎴︽偐鐎圭姴顥濋弶鈺傜箞閺岋絾鎯旈婊呅i梺鍝ュУ閻楁粎妲愰幒妤€鐓涢柛鎰典簽閿涙繃绻涙潏鍓у埌妞ゎ偅鐗犻幊鏍煛閸屾艾绨ラ梻浣虹《閸撴繄绮欓幒妤佸亗闁绘柨鍚嬮悡娆撴⒑椤撱劎鐣辨鐐寸墬閵囧嫰濡烽妷顔煎壎闂佸搫鐭夌紞渚€銆佸鈧幃銏ゆ倻濡儤鐝┑锛勫亼閸婃垿宕濇繝鍥х?闁汇垻枪缁犳牗绻涢崱妯虹仸閻庢碍姘ㄩ幉鎼佸箣閿曗偓鐟欙附銇勯幇鍫曟闁抽攱鍨垮鍫曟倷閺夋埈妫嗛梺鍛婃煥缁夊綊寮婚悢鍏煎仭闁绘鐗嗛弸鐘参旈悩闈涗粶闁哥喐鎸冲畷娲晸閻樻彃绐涘銈嗘尵婵兘宕㈤鍕拻濞达絽鎳欒ぐ鎺撳殣妞ゆ牜鍋涢悿顔姐亜閹般劍瀵f繛宸簼閺呮繈鏌涚仦鍓р槈濞存粍顨婂娲传閸曨剙绐涢梺鍝ュУ閹稿墽鍒掔紒妯稿亝闁告劏鏅濋崢鐢告煟鎼达絾鏆╅弸顏堟煃瑜滈崜姘舵偋閻樿崵宓侀悗锝庡枟閸嬫劖銇勯幇鍨窔濠㈣娲栭埞鎴︻敊閺傘倓绶甸梺鍛婃尰瀹€绋跨暦閹惰姤鍋╃€光偓閳ь剛澹曟總绋跨骇闁割偅绋戞俊浠嬫倶韫囷絽骞楅柕鍥у楠炴﹢鎮欓挊澶夊垝闁诲氦顫夊ú婊堝窗閺嶎厹鈧礁顫滈埀顒勫箖閳哄懏顥堟繛鎴炨缚閸濆酣姊婚崒娆愮グ妞ゆ泦鍛亾濞戞帗娅婃い銏$懇瀵粙顢橀悙鐢靛炊婵犵數鍋為崹顖炲春閸曨垰鏋侀悗锝庡墯閸犳劙鏌¢崘銊у闁哄嫨鍎甸弻鏇熷緞濞戞氨鏆犵紓浣稿閸嬨倝寮婚悢鍏肩劷闁挎洍鍋撳褏绮换娑㈡偂鎼搭垵鍚┑顔硷龚濞咃絿妲愰幒鎳崇喖寮撮悢椋庝紝閻庤娲樼划宀勶綖濠靛鏁勯柍鍝勫€诲ú鎾煙椤斿搫鐏茬€规洘顨堟禍鎼佸冀閵娿儺浼滃┑鐘垫暩閸嬬娀骞撻鍡欑闁逞屽墯缁绘盯宕崘顏呭仹闂佽桨绶¢崰鏍煡婢舵劕顫呴柨娑樺楠炲牓姊绘担鍛婃儓闁哥喓濞€瀹曟垿骞樼€靛摜顔曢梺鍛婄懃椤﹁鲸鏅堕崹顐犱簻闁靛繆鈧啿鎽甸梺杞扮劍閸旀牕顕ラ崟顒傜瘈闁搞儜鍕瘑闂傚倸鍊风粈渚€骞栭鈷氭椽濡搁埡浣猴紱闂侀潧鐗嗛幉妯衡槈閵忊€斥偓濠氭煠閹帒鍔楅柟閿嬫そ濮婂宕掑鍗烆暤闂佸搫鎳忛惄顖炲箚娴g硶鍫柛顐ゅ枔閸樺崬鈹戦埥鍡楃仩闁圭⒈鍋婇崺娑㈠棘濞嗗墽鍞甸柣鐔哥懃鐎氼厾绮堥崘顏嗙<閺夌偞澹嗛惌娆戔偓瑙勬磸閸斿秶鎹㈠┑鍥ㄥ劅闁靛繆鏅滈ˉ濠冪節绾板纾块柛瀣灴瀹曟劙寮介锝嗘婵犵數濮寸€氼噣鎯岄崱妞曞綊鏁愰崨顔藉創缂備浇缈伴崐鏇㈠煘閹达附鍋愮€规洖娴傞弳锟犳⒑缂佹ɑ灏柛鐔跺嵆楠炲绮欐惔鎾崇墯闂佸壊鍋呯换鍕囬鐐╂斀妞ゆ梹鏋绘笟娑㈡煕鎼搭喕绨婚悡銈嗐亜韫囨挻鍣瑰ù婊勭矒濮婅櫣绱掑Ο璇茬闁诲孩绋堥弲娑樺祫濡炪倖甯掔€氼參鍩涢幋鐘电=濞达絽顫栭鍛弿闁搞儺鍓氶悡娆戠棯閺夊灝鑸瑰ù婊呭仧缁辨帡顢欑喊杈╁悑闂佽桨鐒﹂崝鏍ь嚗閸曨厸鍋撻敐搴″鐎殿喗濞婂缁樻媴閸涘﹥鍎撳┑鐐额嚋缁犳捇濡撮崘顔煎窛妞ゆ梻铏庡ú鎼佹⒑閸涘﹥瀵欓柛娑卞灲缁辨煡姊绘担铏瑰笡闁告棑绠撳畷婊冣枎閹惧磭顦梺闈涚墕椤︿即鎮¢弴鐔稿弿婵妫楁晶濠氭煕鎼淬垹鐏撮柡宀€鍠栭悰顕€宕归鍙ユ偅闂備礁鐤囬~澶愬垂閸撲焦宕叉繝闈涙处閸庣喖鏌嶉懜娈垮劌濞存粠浜滈~蹇曠磼濡顎撻梺缁樺灦閿氭繛鍫濈焸濮婅櫣娑甸崨顓夋挾绱掗鑲┬ч柟顔矫埢搴ㄥ箻缁瀚奸梻浣告贡鏋悗娑掓櫇婢规洟骞栨担鍦幈闂侀潧枪閸庢煡骞嗛崼婵堟殕闁挎繂鐗嗛崝鐢电磼閻樺磭鈽夐柍钘夘槸铻i柣鎾抽缁犵増绻濋悽闈涗哗闁规椿浜炲濠冪鐎n亞顔戝┑鐘诧工鐎氼噣銆呴弻銉︾厸濠㈣泛锕﹀銊╂煛閳ь剚绂掔€n偆鍘藉┑鈽嗗灥濞咃絾绂掑☉銏$厸闁糕€崇箲濞呭懘鏌嶇憴鍕伌妞ゃ垺鐟╅幃娆擃敆娴e湱妲楅梻鍌欒兌椤㈠﹤鈻嶉弴鐘冲床闁告劦鍠栧洿闂佹寧绻傞ˇ顖滅矆閸愵喗鐓冮弶鐐村閸忓瞼鎲搁弶鎸庡殗婵﹦绮幏鍛存惞閻熸壆顐奸梻浣告惈鐞氼偊宕濋幋婵堟殾闁靛/鈧崑鎾绘晲鎼粹剝鐏嶉梺绋款儏閸婂潡鎮¢锕€鐐婇柕濠忛檮閸庡酣姊虹紒妯荤叆婵☆偅绻堝濠氬Χ婢跺﹣绱堕梺闈涱檧闂勫嫬袙閸曨垱鈷戦悗鍦У椤ュ銇勯敂鍨祮濠碉紕鏁诲畷鐔碱敍濮樺崬骞愬┑鐘垫暩婵挳宕愰幖浣哥厱閻庯綆鍠楅埛鎴︽煕濠靛棗顏繝鈧幍顔剧<閻庯綆鍋勯悘鎾煥濠靛牆浠滄顏冨嵆瀹曠厧鈹戦崱姘e亾閸ф鈷戦柛婵嗗閸屻劑鏌涢妸顭戞綈缂佸倹甯¢獮鍥敇閻樼數妲囩紓浣稿⒔婢ф鎽銈庡亜閿曨亪寮诲☉姘e亾閿濆簼绨绘い蹇e幗椤ㄣ儵鎮欑拠褍浼愬銈庡亝缁捇宕洪埀顒併亜閹烘垵顏╂潻婵囩箾閹炬潙鐒归柛瀣尵閳ь剚顔栭崰妤呭箰閾忣偅鍙忛柍褜鍓熼弻锝呪枎鐏炴垝澹曟繝鐢靛仧閸樠囨晝椤忓嫷娼栨繛宸簻濡﹢鏌曟径娑㈡闁绘繃妫冨娲传閵夈儲鐝¢梺鎼炲姀濞夋盯鎮鹃悜钘夌疀闁绘鐗忛崣鍡涙煟鎼搭垳宀涢柡鍛箘缁顫濋懜纰樻嫼缂傚倷鐒﹂敋濠殿噯绠戦湁婵犲﹤瀚惌鎺楁煕閳规儳浜炬俊鐐€栫敮濠囨嚄閼稿灚娅犻柣銏㈩暯閸嬫挾鎲撮崟顒傤槬缂傚倸绉撮敃顏堢嵁閸愵喗鍋╃€光偓閳ь剟鎯屽▎鎾村仯闁诡厽甯掓俊鍧楁煛鐎n亜鏆炵紒缁樼箓閳绘捇宕归鐣屼憾闂備線娼уú锕傛儎椤栨氨鏆﹂柟杈剧畱缁犲鏌涢妸锔锯槈濞存粓绠栭幃宄扳枎韫囨搩浠剧紓浣插亾闁告劏鏅欑换鍡涙煟閹邦厼顥嬮柣顓熺懅閳ь剝顫夊ú妯侯渻娴犲鏄ラ柍褜鍓氶妵鍕箳瀹ュ顎栨繛瀛樼矋缁捇寮婚悢鐓庝紶闁告洦鍘滆娣囧﹪骞嗚濡插妫佹径瀣瘈濠电姴鍊搁顐︽煟椤撶喎娴柡灞糕偓宕囨殕闁逞屽墴瀹曚即寮借閺嗭附銇勯幇鍓佺暠缂佲偓鐎n偁浜滈柟鐐墯濡插爼鏌涙繝鍐疄鐎殿喛顕ч埥澶愬閻樻剚妫熼梺鑽ゅУ娴滀粙宕滈柆宥呂ч柛銉㈡櫇閿涙粓鏌℃径濠勫闁告柨鑻湁妞ゆ洍鍋撻柡灞剧洴閸╃偤骞嗚婢规洖鈹戦敍鍕杭闁稿﹥鐗滈弫顔界節閸曨厾鐒兼繛杈剧悼閸庛倝顢曟禒瀣厽闁归偊鍣弳顖炴煕鐎n偅宕岀€规洘顨嗗鍕節娴e壊妫滈梻鍌氬€风欢姘跺焵椤掑倸浠滈柤娲诲灡閺呭爼寮跺▎鍓у數闁荤喐鐟ョ€氼厾绮堢€n喗鐓欓柧蹇e亞婢х敻鏌涢埡瀣瘈鐎规洘锕㈤、鏃€鎯旈敐澶嬶紬婵犵數濮烽弫鎼佸磻閻樿绠垫い蹇撴缁躲倕霉閻樺樊鍎滅紓宥嗙墵閺屸€愁吋鎼粹€冲闂佽桨绀侀崐鍧楀蓟濞戙埄鏁冮柨婵嗘川閻h京绱撴担绋胯埞闁绘牜鍘ч~蹇涙惞閸︻厾锛滃┑鈽嗗灥濞咃絾绂掗幖浣圭參闁告劦鍠曢幉楣冩煛鐏炲墽鈽夐柍璇叉唉缁犳盯寮撮悪鈧崬鍫曟⒒娴e摜鏋冩い顐㈩樀瀹曞綊宕稿Δ鈧粻鏍煃閸濆嫭鍣圭紒鐘垫暬閺岀喖鎮滃Ο鑲╃暠缂備浇椴搁崹鍨潖閸濆嫅褔宕惰閸旀挳姊洪幖鐐插濞存粌鐖奸獮鍡涘礋椤栵絾鏅梺缁樺姌鐏忣亪骞楅弴銏♀拺缂備焦蓱椤ュ牊銇勯妷锔藉磳鐎殿喖纾埀顒婄秵閸犳鎮¢悢闀愮箚闁靛牆鍊告禍楣冩⒑缂佹﹩娈旀俊顐n殜閸┿垽骞樺鍕瀹曘劑顢欑亸鏍т壕闁汇垹鎲¢崑鈩冪箾閸℃绠版い蹇d簽閻ヮ亪鎮欓浣糕偓鎰版煛鐏炲墽娲寸€殿噮鍣i崺鈧い鎺戝閸ㄥ倸霉閿濆懎鏆熷ù婊堜憾濮婄粯鎷呴崨濠傛殘闂佸憡姊归崹鍨暦濠靛洤绶炲┑鐑嗘緛缂嶄礁鐣锋總鍛婂亜缂佸鐏濇导搴㈢節绾版ɑ顫婇柛銊╂涧閻g兘妫冨ù宕囧枛瀹曟帡鎮欑€电ǹ甯惧┑鐘垫暩閸嬬喖宕戦幘鏂ユ瀺闁糕剝绋掗悡鏇炩攽閻樻彃鈧粯绂掑☉姘辩<缂備焦岣垮ú瀵糕偓瑙勬礈閸樠囧煘閹达箑閱囨繝濠傛椤庢姊婚崒娆戭槮闁圭⒈鍋婇、鏍礃椤旇偐锛欏┑鐘绘涧椤戝懘鎷戦悢鍏肩厓闁宠桨绀侀弳鐐测攽椤栨稒灏﹂柡灞剧洴楠炴﹢鎮烽幍顔筋嚄闂備礁鎲¢懝楣冾敄婢跺⿴娼栨繛宸簼椤ュ牊绻涢幋鐐垫噽婵☆偅绋撶槐鎾存媴閹绘帊澹曞┑鐐舵彧缁插潡寮查锝囶洸婵炲棙鎸婚埛鎺懨归敐鍛暈闁哥喓鍋涢妴鎺戭潩椤撗勭杹閻庤娲忛崹娲Χ閿濆绀傛い鏍ㄧ閸犳ḿ鈧鍠涘▔娑㈠煝鎼淬劍鍊锋い鎺嗗亾闁伙附绮撳缁樼瑹閳ь剙岣胯閹囧幢濡炪垺绋戣灃濞达絿鎳撳鍧楁⒑缁嬭法鐏遍柛瀣仱閹繝寮撮悙鈺傛杸闂佺粯鍔樼亸娆愮閵忋倖鐓冪憸婊堝礈濮橆優娲冀瑜忛弳銈夋煕閺囥劌鐏¢柍閿嬪笒閵嗘帒顫濋浣规倷婵犫拃灞芥灓缂佽鲸甯楀鍕沪閻愵剚鐦撻梻浣虹《閺呮粓鎯勯鐐靛祦闁圭儤顨呯粻鐘绘煏婵炲灝鍔ょ紒澶嬫そ閺屸剝鎷呴悷鏉款潚閻庤娲栭妶鎼佸箖閵堝棙濯撮悹鍥e墲椤ュ姊婚崒姘偓椋庣矆娓氣偓楠炲鏁撻悩鍐叉疄闂佸憡鎸嗛崨顖fЦ濠电姷鏁告慨鏉懨洪妶澶嬪珔闁绘柨鎽滅粻楣冩煙鐎涙ḿ鎳冮柣蹇d邯閺屾稓鈧綆鍋勬慨宥夋煛鐏炲墽娲存鐐叉喘椤㈡﹢鎮欓悽鐐瑰仭濠碉紕鍋戦崐銈夊磻閸涱垱鏆滈柨鐔哄Т缁犳牗淇婇妶鍛殲闁哥姴妫濋弻娑㈠即閵娿儱顫銈忚礋閸斿秶鎹㈠┑瀣仺闂傚牊绋愮划鍫曟⒑閹稿孩纾搁柛濠冪箞閵嗕礁顫濋懜鍨珳婵犮垼娉涢敃顏堝船閸洘鈷戦柛婵嗗瀹告繈鏌涚€n剙鏋涢柟顔兼健瀹曞爼顢楁担鍙夊闂傚倸鍊搁悧濠勭矙閸喐鍎熼柣鎴eГ閳锋帡鏌涢弴銊ヤ簻妞ゅ浚鍘奸埞鎴︽晸閻樿櫕閿梺瀹狀潐閸ㄥ灝鐣烽崼鏇炍ㄩ柕鍫濇川濞夊潡姊婚崒娆戠獢婵炰匠鍛床闁糕剝绋戠粈鍫熺節闂堟稓鎳佸鑸靛姇闁卞洭鏌嶉崹娑欐珔濞存粓绠栭幃宄扳枎韫囨搩浠剧紓浣插亾闁割偁鍎查悡鏇㈡煟濡櫣锛嶅褏鏁婚弻鐔碱敊鐠囨彃绁銈冨灪瀹€鎼佸春閳ь剚銇勯幒鎴濐仴闁逞屽厸缁€渚€鍩ユ径濠庢建闁糕剝锚閸忓﹥淇婇悙顏勨偓鏍暜婵犲洦鍤勯柤鍝ユ暩椤╂彃螖閿濆懎鏆為柍閿嬪笒闇夐柨婵嗙墛椤忕娀鎮介娑氭创闁哄矉绱曟禒锔炬嫚閹绘帩鐎抽梺鎹愬吹閸嬬偟鎹㈠┑瀣棃婵炴垵宕崜鎵磽娴e搫校闁绘濞€楠炲啫鐣¢幍铏€婚棅顐㈡处閹尖晜绂掗悙顒傜瘈婵炲牆鐏濋弸鐔虹磼椤旇姤宕岀€殿喖顭烽幃銏☆槹鎼淬垺鐤傞梻浣筋潐椤旀牠宕板璺虹闁归棿鐒﹂埛鎴︽煕濞戞﹫鏀婚柣鎾卞劦閺岀喖鎼归鈧鍫稏闊洦绋掗幆鐐烘煕閿旇骞橀柣鎾存崌濮婃椽宕滈懠顒€甯ラ梺闈╃秵閸o絽鐣峰┑鍥х窞闁归偊鍘搁幏娲⒑绾懎浜归柛瀣⊕娣囧﹪宕楅懖鈺冾啎闁诲繐绻戦悧鎴﹀磻閹捐绠涘ù锝呮啞椤撳潡姊洪懡銈呅㈡繛璇у缁﹪寮堕幊绛圭秮瀹曞ジ鎮㈤崜浣虹暰婵$偑鍊栭悧妤冪矙閹剧粯鍎楃€光偓閸曨剛鍘遍梺缁樏壕顓熸櫠椤忓牊鐓熼柨婵嗘搐閸樺瓨銇勯姀鈩冪闁轰礁鍟撮崺鈧い鎺戝€婚惌鍡涙倵閿濆骸浜栧ù婊勭矒閺岋繝宕橀妸锔芥倷婵炲瓨绮岀紞濠囧蓟濞戞鐔虹磼濡搫鏀繝娈垮枛閿曘倝鈥﹀畡鎵殾闁圭儤鍨熼弸搴ㄦ煙閹碱厼骞楃悮锕傛⒒閸屾瑧鍔嶉柣顏勭秺瀹曟劙寮撮悘缁樻そ椤㈡﹢濮€閳╁啯鐝抽梻浣虹帛閸旀牕岣垮▎鎴烆偨闁绘劗鍎ら悡娆撴⒑椤撱劎鐣卞褜鍣i弻锝嗘償椤旂厧绫嶅┑顔硷龚濞咃絿鍒掗弮鍫濆耿婵°倐鍋撴い蹇撶摠缁绘盯宕奸悢绯曟嫽缂備浇椴哥敮锟犲箖閳轰胶鏆﹂柛銉戝本妞掔紓鍌氬€烽懗鍓佸垝椤栫偞鍎庢い鏍ㄦ皑閺嗭箓鏌涘Δ鍐ㄢ偓锝夋偄閻戞ê鐝伴梺鑲┾拡閸擄箓寮抽敓鐘斥拻闁稿本鐟ч崝宥嗕繆閻愬弶鍋ョ€规洏鍨虹粋鎺斺偓锝冨妷閸嬫捇宕橀鐓庣獩缂備緡鍠栭崢婊堝磻閹剧粯鏅濋柛灞惧哺閺佹粌鈹戞幊閸婃挾绮堟担绯曟灁婵犻潧顑嗛埛鎴炵箾閼奸鍤欏褑顕ч湁婵犲﹤瀚粻鐐碘偓瑙勬礀缂嶅﹤鐣风粙璇炬棃鍩€椤掑嫬鍑犲ù锝堛€€閸嬫捇鐛崹顔煎濠碘槅鍋呴惄顖炲箖閻ゎ垬浜归柟鐑樻尵閸樻捇鎮峰⿰鍕煉鐎规洘绮岄埢搴ㄥ箼閸曨厾鈼ら梻濠庡亜濞诧箑煤濠婂懎顥氶柛蹇涙?缁诲棙銇勯弽銊х闁搞倖鐟﹂妵鍕償閵忊€崇3濠殿喖锕ュ钘夌暦閵婏妇绡€闁告洏鍔嶉~宥夋⒒娴g懓顕滄繛鎻掔箻瀹曟劕鈹戦崱鈺佹闂佽鍎煎Λ鍕煁閸ャ劎绡€闂傚牊绋戦弳鐐烘煛閸屾浜炬繝纰夌磿閸嬫垿宕愰弽褜娼栧┑鐘宠壘杩濋柣搴秵閸犳牜绮堟径鎰厽闁哄倸鐏濋幃鎴︽煟閹惧鎳囬柡灞熷棛鐤€闁挎繂鎳嶇花濂告煟韫囨挾绠抽柡浣割煼瀵鈽夊Ο閿嬬€婚棅顐㈡处閺屻劌鈻撳Δ鈧埞鎴︻敊绾兘绶村┑鐐叉嫅缁插灝危閹版澘绠抽柟鍐茬-閸犳牠骞冨⿰鍫濈厸闁稿本鍑规导婊堟⒒閸屾艾鈧绮堟笟鈧獮澶愭晸閻橆偀鍋撻敃鍌氬耿婵炴垶锚缁愭稑顪冮妶鍡欏闁荤啙鍥ㄥ仭婵犻潧顑嗛埛鎺懨归敐鍛暈闁诡垰鐗忕槐鎺撳緞鐎n剙寮ㄩ悗瑙勬礃缁诲倿顢橀崗鐓庣窞濠电姴瀚崢顒勬⒒婵犲骸浜滄繛璇х畵瀵槒顦撮柟骞垮灲瀹曞崬鈽夊▎鎴濆箺闂備線鈧稑宓嗛柛瀣躬瀵泛煤椤忓懐鍘遍梺闈涚墕濡盯骞婇崘顔筋梿濠㈣泛顑囩弧鈧繝鐢靛Т閸婄粯鏅堕姀銈嗙厽闁挎繂娲ら崝瀣煙娓氬灝濡界紒缁樼箞瀹曘劑顢氶崨顒€鎽嬮梻鍌欑閹诧繝鎮уΔ鍛亱闁绘ê妯婇崵鏇㈡煙缂併垹鏋熼柛瀣閺屾稑鈹戦崟顐㈠闂佸憡鎸婚崹鍦閹捐纾兼慨姗嗗厴閸嬫捇鎮滈懞銉ユ畱闂佸憡鎸风粈渚€宕瑰┑鍥ヤ簻闁哄秲鍔庨惌瀣偓瑙勬礃閻擄繝寮诲☉妯兼殕闁逞屽墴瀹曟垿鎮欓崫鍕紱闂佸啿鎼幊蹇涙偂閻斿吋鐓欓弶鍫濆⒔缁嬬粯銇勯妷銉Ш缂佽鲸甯¢幃鈺呮倻濡厧娑у┑鐑囩到濞层倝鏁冮鍛箚闁割偅娲栫壕鍏兼叏濮楀棗浜滄い銉﹀哺濮婄粯鎷呯憴鍕哗闂佺ǹ瀛╅悡锟犵嵁閹版澘绀冪€瑰壊鍠楃紞搴ㄦ⒑閹呯闁硅櫕鎸鹃埀顒€鐏氶悡锟犲蓟閿熺姴鐐婇柍杞扮劍閻濓繝姊洪柅鐐茶嫰婢ь喗淇婇锝囩疄鐎殿喖顭烽弫鎾绘偐閹绘帞鐛╂俊鐐€栧濠氬磻閹捐绀嗘繛鎴欏灪閸婂灚绻涢崼婵堜虎闁哄鍠栭弻锝夊箼閸曨厾鐦堥梺闈涙缁€浣界亙闂佸憡渚楅崢楣兯囬弶娆炬富闁靛牆妫楅悘鍗炩攽椤斿搫鈧鍩€椤掍胶鐓紒顔界懃椤繒绱掑Ο璇差€撻梺鍛婄洴濞佳呯礊婵犲偆鍤曢柣銏犲閺佸棝鏌涢弴銊ュ濞寸媭鍙冨娲濞淬儱鐗撳鎻掆槈濮樿京鐒奸梺绋挎湰婢规洟宕戦幘璇茬濠㈣泛锕f竟鏇㈡⒒娓氣偓閳ь剛鍋涢懟顖涙櫠閻楀牅绻嗛柛娆忣槸婵秵顨ラ悙鏉戠瑨閾绘牕鈹戦悩鎻掓殲婵炲懏妫冨缁樻媴閸涘﹤鏆堟繛鎾寸椤ㄥ﹤鐣烽姀銈嗗€锋い鎺戝亞濞村嫰姊鸿ぐ鎺擄紵闁绘帪绠撳畷鎰版偨閸涘﹤浠┑鐐叉缁绘劙顢旈鍡欑<闁逞屽墴瀹曟﹢顢旈崱娆欑床闂佽崵濮村ú鈺冧焊濞嗘劖娅犻柡鍥╁枂娴滄粓鏌¢崶鏈电敖缂佸鍠楅〃銉╂倷鏉堟崘鈧寧銇勯姀锛勬噰闁圭ǹ锕ュ鍕幢濡炴儳顥氬┑鐘垫暩婵數鍠婂澶嬪亗闁哄洢鍨洪悡鍐煃鏉炴壆顦﹂柡瀣ㄥ€栫换娑㈠醇閻斿摜顦ㄩ梺闈涙搐鐎氫即鐛鈧幖褰掝敃椤厽妯婂┑鐘愁問閸犳牠鏁冮敂鎯у灊妞ゆ牜鍋涚粻顖炴煕濞戝崬鐏i柣顓熺懄缁绘盯宕卞▎蹇庡濡炪們鍎查崹鍨潖缂佹ɑ濯撮柛娑㈡涧缂嶅﹪銆侀弽顓炲窛闁哄鍨归悿鍥煙閼圭増褰х紒鑼舵椤曪綁寮婚妷锔规嫽婵炶揪绲介幉锟犲箚閸垻纾奸悗锝傛櫇缁愭梻鈧娲橀崹鍨暦閸楃偐妲堟繛鍡楃箣閾忓海绱撻崒姘偓鐑芥倿閿旂偓绠掔紓鍌欐祰椤曆兾涘┑瀣摕闁哄洢鍨归柋鍥ㄧ節闂堟稒锛嶅ù鐘冲劤椤啴濡惰箛鏇犳殼濡炪們鍎查幐鎯i幇鏉跨闁哄啠鍋撻悗姘哺閺屾稑鈻庤箛锝嗏枔濠碘槅鍋撶换婵嗩潖濞差亝顥堟繛鎴炵懄閹瑩鏌f惔銏㈩暡婵犮垺锕㈤、姘舵晲閸℃瑯娴勯柣搴秵閳ь剦鍘搁弲鐘诲蓟閵娾晛绫嶉柛灞剧煯婢规洖顪冮妶鍡樺暗缂侇噮鍨抽幑銏犫攽閸″繑鐏侀梺鍓茬厛閸犳鎮甸婊呯=濞达絿鎳撶徊缁樼箾鐏忔牑鍋撳畷鍥ㄦ闂佺鎻粻鎴濇纯濠电姰鍨煎▔娑㈡晝閵娾晛绠洪柡鍥╁亹閺€浠嬫煟閹邦厽缍戦柣蹇ョ畵閺屾盯鍩℃担鍛婃閻庤娲橀崹鍧楃嵁濡偐纾兼俊顖滅帛閻濇娊姊虹涵鍛汗閻炴稏鍎甸崺鈧い鎺戝暙閻ㄦ椽鏌涢幋婵堢Ш婵﹨娅i幏鐘绘嚑椤掑偆鍞舵繝鐢靛仜閻°劌鐣濈粙璺ㄦ殾闁挎繂顦粈鍐┿亜閺冨洤顥嶉柟鑺ユ礋閹鐛崹顔煎濠电偛鐪伴崝搴㈢珶閺囥垹绀傞梻鍌氼嚟缁犳艾顪冮妶鍡欏缂佽绉瑰畷闈涒枎閹寸姵锛忛梺缁樺姦閸撴瑩鍩㈤弴銏$厵妞ゆ梻鐡斿▓姗€鏌熼崣澶嬪唉鐎规洜鍠栭、妤呭磼閵堝柊姘辩磽閸屾艾鈧悂宕愰崫銉х煋闁圭虎鍠楅弲婵囥亜韫囨挾澧曟潻婵囩箾鏉堝墽鎮肩痪顓炵埣瀵憡鎯旈妸锔惧幍闂佺粯鍔﹂崜姘辩礊閹存緷褰掓偐鐏炲倸浠梺鍝勭焿缂嶁偓缂佺姵鐩鎾倷閻楀牆鐓曢梻鍌欑閹诧繝鈥﹂崱娑樼倞濞达絽澹婂Σ鍛娿亜椤愶絿绠為柟铏矌閸犲﹤螣鐠囧樊浼滈梻鍌氬€烽懗鑸电仚闂佸搫鐗滈崜鐔煎箠濠靛洢鍋呴柛鎰╁妿閸旓箑顪冮妶鍡楀潑闁稿鎹囬弻娑㈠閿涘嫬寮ㄥ┑鐘亾濞撴埃鍋撴慨濠冩そ楠炴牠鎮欓幓鎺懳楅梺璇茬箳閸嬫稒鏅舵禒瀣ㄢ偓鍛搭敃閿旇В鎷绘繛鎾村焹閸嬫挻绻涙担鍐叉濞咃綁姊绘担鍛婂暈濞撴碍顨婂畷褰掑箮閽樺顦柣鐘荤細閵嗏偓闁衡偓娴犲鐓熼柟閭﹀墰閹界娀鎮樿箛搴″祮闁哄本鐩崺鈩冩媴閸涘﹥顔掗柣搴ゎ潐濞叉﹢宕归崸妤冨祦婵☆垵鍋愮壕鍏间繆椤栨粌甯堕悽顖涱殜濮婄粯绗熼埀顒€岣胯钘濆ù鐘差儏閸ㄥ倿鏌熼幆鏉啃撻柛瀣ф櫊閺岋綁濮€閻樺啿鏆堥梺缁樻尰閻燂箓濡甸崟顖氱睄闁稿本绋掗悵顏堟⒑濞茶骞楅悽顖ょ節瀵鎮㈤搹鍦厯闂佸憡鐗戦崜婵嬪极閸撗呯=濞达綀顫夐埛鎺楁煕閻樺磭澧电€规洘妞介幃娆撳传閸曨偆鈧厼顪冮妶鍡樷拻闁告鍥风稏闁瑰墽绮埛鎺楁煕鐏炲墽顣查柟鍏煎姈閵囧嫰鏁傞悙顒佹瘓閻庢鍠栭…閿嬩繆閹间礁唯闁靛繆鍓濋弶鎼佹⒒娴h櫣銆婇柛鎾寸箞閹兘濡烽埞搴撳亾閸屾娲敂閸涱亝瀚奸梻鍌欑贰閸嬪棝宕戝☉銏″殣妞ゆ牜鍋涢崒銊╂煕濠靛嫬鍔ょ痪鎯у悑閵囧嫰寮崒娑欑彧闂佺懓鍟块崯顖炲Φ閸曨垰鍗虫い蹇撴琚︽俊鐐€戦崹鍝勭暆閹间礁鏄ラ柍褜鍓氶妵鍕箳閸℃ぞ澹曢梻浣风串缁插潡宕楀鈧獮鍐焺閸愨晛鍔呭┑鈽嗗灣缁垶寮堕幖浣光拻濞达綀娅i妴濠囨煕閹惧绠為柟顔炬焿椤︽煡鏌i敐鍥у幋鐎规洦鍋婂畷鐔煎Ω閿旇姤婢戦梻鍌欑劍鐎笛呯矙閹寸姭鍋撳鐓庡缂佸倸绉电缓浠嬪川婵犲嫬骞堝┑鐘垫暩婵挳宕悧鍫熸珷闁割煈鍋掑▓浠嬫煟閹邦厽缍戝┑顔肩Ч閺岀喖顢欓悾灞惧櫚濡炪們鍨洪〃濠囧春閳ь剚銇勯幒鎴濐仼闁搞劌鍊块弻锟犲礃閵娧冾杸闂佺ǹ锕﹂弫璇差潖婵犳艾閱囬柣鏃囥€€婵洭姊洪崫銉ユ灁闁稿鍋ゆ俊鐢稿礋椤栵絾鏅濋梺鎸庣箓濡盯藝娴煎瓨鈷戦柛婵嗗濠€鎵磼鐎n偄鐏撮柛鈹垮灪閹棃濡堕崶鈺傛緫闂備焦瀵х换鍌炲蓟婵犲洤惟鐟滃繒澹曢挊澹濆綊鏁愰崨顓犻獓濡炪倕楠稿Λ婵嬪蓟濞戞埃鍋撻敐搴′簼鐎规洖鏈幈銊︾節閸曨厼绗¢梺鐟板槻閹虫ê鐣烽悜绛嬫晣闁绘棁顕ч崡鎶芥⒒閸屾瑧鍔嶉柟顔肩埣瀹曟繆绠涢幘鎰洴瀹曠喖顢曢妶鍛唽闂備礁鍚嬮崜姘跺垂閻撳宫锝嗙節濮橆厸鎷洪梺缁樺灍閺呮粓锝炴繝鍥ㄧ厱婵炲棗绻愰弳娆愩亜椤愩垻绠崇紒杈ㄥ笒铻i悹鍥ф▕閳ь剚鎹囧娲嚒閵堝懏鐏堥梺绋款儏閿曨亜鐣烽悽纰樺亾閿濆簼绨撮柡鈧禒瀣厽闁归偊鍘界紞鎴犵磼閼艰泛鍚圭紒杈ㄥ笧缁辨帒螣韫囷絼閭柟顕€绠栭幃婊堟寠婢跺瞼鏉告俊鐐€栭崹鍏兼叏閵堝妫橀柍褜鍓熷缁樻媴閾忓箍鈧﹪鏌涢幘瀵哥疄闁诡喚鍏橀弫鍐焵椤掑嫬鐓濋柟鎹愵嚙缁犳氨鎲稿⿰鍐︹偓鎺撶節濮橆厾鍘梺鍓插亝缁诲啴藟閻樺樊鐔嗙憸鏃€绂嶉崼鏇炶摕婵炴垶鍩冮崑鎾绘晲鎼粹€茬敖闂侀潧妫欑敮鐐垫閹烘鏁婄痪鎷屼含閸氬顪冮妶鍐ㄧ仾闁荤啿鏅涢悾宄扳堪閸♀晜鞋闂備焦瀵х粙鎺斿垝瀹€鍕厴闁硅揪闄勯崐鐑芥煛婢跺鐏╁ù鐘虫倐濮婃椽骞愭惔銏紩闂佸搫鎳愭慨鎾偩閻戣棄鍗抽柕蹇曞Х閻も偓闂備胶绮〃鍛存偋韫囨稑鍌ㄩ柟闂寸劍閳锋垿鏌涘☉姗堟缂佽泛宕湁婵犲﹤瀚粻鎾绘煃鐠囪尙效鐎规洖宕埢搴ㄥ箣閻欏懐搴婄紓鍌氬€搁崐鐑芥倿閿曗偓閻滆崵鎹勯妸褌绗夐梺缁樺姈缁佹挳寮ㄩ懞銉d簻闁哄啫鍊归崵鈧繛瀛樼矒缁犳牕顫忕紒妯诲闁荤喖鍋婇崵瀣磽娴g瓔鍤欓柛濠傛健閻涱喗绻濋崶褏鐤€闂佸搫顦悘婵嬪磻瀹ュ拋娓婚柕鍫濇婵囨⒒閸曨偄顏柛鈺傜洴楠炲鏁傞悾灞藉箞婵犵數鍋為崹鍫曟晝椤愶箑缁╁┑鐘崇閻撳啴姊洪崹顕呭剰濠殿喖绉归弻鈥崇暆鐎n剙鍩岄柧缁樼墵閺屾盯骞囬埡浣肝ㄩ梺鍝勵儏閹虫﹢骞冨Δ鍐╁枂闁告洦鍓涢ˇ銉╂⒑閸︻厸鎷¢柛瀣躬瀹曟椽濡烽敃鈧欢鐐烘煙闁箑澧绘繛鐓庯躬濮婅櫣绱掑Ο鏇熷灴椤㈡瑩寮介鐐跺煘濠电偛妯婃禍婵嬪煕閹烘嚚褰掓晲閸涱喖鏆堥柣鐘冲姧缁绘繈寮诲☉姘e亾閿濆啫濡煎┑顔煎€婚埀顒冾潐濞叉ḿ鎹㈤崒鐐村仼婵犻潧顑呴悞鍨亜閹烘垵鈧綊锝為弴銏$厽闁归偊鍓﹂崵鐔虹磼閳锯偓閸嬫捇姊绘担瑙勫仩闁稿孩绮撳畷鐔碱敇濞戞ü澹曞銈嗗笒鐎氼參鍩涢幋锔界厱闁挎棁顕ч獮鏍ㄣ亜閿濆懎鎮戠紒缁樼箞婵偓闁愁參顤傛禍顏堛€佸▎鎺旂杸闁圭虎鍨遍弬鈧梻浣规偠閸庮垶宕曢幍顔垮С濠电姵纰嶉埛鎴︽煕濠靛棗顏╅柍褜鍓氶幃鍌炲箖濡 鏀介悗锝庝簽閻f椽姊洪悷閭﹀殶闁稿鍠撶划缁樸偅閸愨晝鍘卞銈嗗姂閸婃洖鈻嶉幇鐗堢厾闁绘鐗嗛婊堟煙娓氬灝濡界紒缁樼箞瀹曠喖顢橀悙娈垮仹闂傚倷鑳堕幊鎾诲床閺屻儱绠犻柟閭﹀枛閸ㄦ繈鏌i姀銏╂毌闁稿鎹囬弫鎰償濠靛牆鍤梻浣风串缁插ジ宕¢崘宸綎缂備焦蓱婵挳鎮峰▎蹇擃仼濞寸姭鏅犲娲川婵犲啰鍙嗗銈嗗灥椤︻垶鎮鹃悜鑺ユ櫢闁绘ǹ灏欓鍛存⒑閼恒儍顏埶囬柆宥嗗仼婵炲樊浜濋崑鈩冪節婵犲倸顏い銉ョ墦閺岋絽鈽夐崡鐐寸亪闁句紮缍侀弻娑滅疀閺囩偛浠橀梺缁樼箑閸楀啿顫忓ú顏呭殞闁哄顑欏Λ鍫ユ⒑缁洘娅嗛柣妤冨█閻涱喗寰勭€n亶鍤ら柣搴㈢⊕鑿ら柟椋庣帛缁绘稒娼忛崜褎鍋ч梺纭呮珪閹瑰洭銆佸顑藉牚闁告侗鍨抽敍婊堟煟閻樺弶澶勭憸鏉垮暣閸┾偓妞ゆ巻鍋撴繛纭风節閹即顢欓挊澶岀獮婵犵數濮寸€涒晛顕欏ú顏呪拺闂侇偆鍋涢懟顖涙櫠椤斿浜滈柡鍥朵簽缁夘喗銇勯姀鈥冲摵闁糕斁鍋撳銈嗗坊閸嬫捇鏌i敐鍥у幋闁诡喒鍓濋幆鏂课熺紒妯绘緫闂傚倷绀佹竟濠囧磻閸涱垱宕查柛灞剧箥閺夌儤绻濋悽闈浶ユい锝庡枤濡叉劙寮撮姀鐘碉紱闂佺鎻粻鎴犲瑜版帗鐓涚€规搩鍠栭懟顖炲疾閻樺磭绡€闁汇垽娼ф牎闂佽偐鎳撴晶鑺ョ珶閺囩喓绡€婵﹩鍘鹃崢鐢告⒑閸涘﹥瀵欓柛娑卞幘椤愬ジ姊绘担渚敯婵炲懏娲栭悾婵嬪箹娴f瓕鎽曢梺鎸庣箓椤︻垳绮诲☉娆嶄簻闁圭儤鍩堝Σ鍛婄箾閸繂顣崇紒杈ㄦ尰閹峰懘宕f径妯峰亾閸℃稒鐓曢悗锝庡亝瀹曞本鎱ㄦ繝鍌ょ吋鐎规洘甯掗~婵嬵敄閽樺澹曢梺褰掓?閻掞箓宕戠€n亖鏀介柣妯哄级閹兼劗绱掗埀顒勫礃閵娿垺鏂€闂佺粯锚閻ゅ洦绔熷Ο鑲╃=濞达絽寮跺▍鍥╃磼鏉堛劍灏伴柟宄版噺椤ㄣ儵濡搁敂鍓х厑缂備礁鍊哥粔鎾偑娴兼潙閱囬柣鏂挎惈鐢儳鈹戦悩顔肩伇闁糕晜鐗滅划娆撳箻鐠囪尙顦繛瀵稿帶閻°劑鎮¢崘顏呭枑婵犲﹤鐗嗙粈鍫熸叏濡潡鍝虹€规洘鐓¢弻娑樼暆閳ь剟宕曢幋鐘电闁哄稁鍘鹃崣鎾绘煕閵夛絽濡界紒鈧崼銏㈡/闁诡垎鍐╁€繛锝呮搐閿曨亪銆佸☉妯锋斀闁归偊鍓氶鍕繆閻愵亜鈧洜鈧稈鏅犻獮鎰板礈瑜庨~鏇㈡煙閹呮憼濠殿垱鎸抽弻娑㈡晜鐠囨彃绠板┑鈩冨絻閻楀棝鈥旈崘顔嘉ч柛鈩冾殘娴犳潙鈹戦埥鍡椾簼缂佸鎸稿嵄闁规壆澧楅崐鐑芥煕濠靛棗顏柛鐐舵硾閳规垿鎮╅懠顑跨驳闂佸憡姊归悧婊堝焵椤掑嫭娑ч柣顓炲€搁~蹇撁洪鍜佹濠电偞鍨堕懝楣冦€傞崫鍕ㄦ斀闁宠棄妫楁禍婵嬫煟閻斿弶娅婄€规洖鎼埥澶愬閻樼數鏉搁梻浣虹帛椤ㄥ懘鎮ц箛娑樺偍闁芥ê顦弨浠嬪箳閹惰棄纾归柡鍥ュ灩閻ゎ喗銇勯幇鈺佺伄闁瑰鍎靛濠氬磼濞嗘劦妯傜紓渚€纭搁崰姘嚗婵犲洤閿ゆ俊銈傚亾缂佲偓閸屾稐绻嗘い鏍ㄧ懆椤掔喖鏌涢妶鍡樼闁诡喛顫夐妶锔炬啑閵堝倸浜鹃柍褜鍓熼弻锛勨偓锝庝邯閸欏嫰鏌″畝瀣М妤犵偛娲Λ鍐ㄢ槈濮楀棙浜ら梻鍌欒兌鏋紒缁樺姍閺佸啴顢旈崟鍨稁缂傚倷鐒﹁摫濠殿垰顕槐鎺斺偓锝庡亜椤曟粓鏌涙繝搴$仸婵﹨娅i幏鐘诲灳閾忣偆浜梻浣呵归敃锔界仚闂佺粯绮岄…鐑藉箠濡ゅ拋鏁嶉柨婵嗘閺嬪矂姊虹拠鍙夊攭妞ゎ偄顦叅婵☆垳鍘ч崹婵嬬叓閸ャ劎鈽夊鍛存⒑閸︻厼顣兼繝銏♂缚缁骞庨懞銉у幍缂傚倷闄嶉崹褰掓倶閿熺姵鍊垫慨姗嗗厵閸嬨垺鎱ㄦ繝鍕笡闁瑰嘲鎳橀幐濠冨緞婵犲啫鍔掗梻鍌欑閹芥粍鎱ㄩ悽绋跨闁哄洠鎳囬埀顒婄畵瀹曞綊顢氶崨顔肩紦闂備線鈧偛鑻晶瀵糕偓瑙勬礀閹碱偊鍩ユ径鎰潊闁绘ḿ鏁稿ḿ澶愭⒒娴e懙褰掑嫉椤掑倸鍨濋幖娣妽閺咁剚绻濇繝鍌氭灓婵炴挸顭烽弻鏇㈠醇濠靛浂妫$紓浣插亾闁逞屽墴濮婃椽鎮烽弶鎸庢瘣闂備礁搴滅紞渚€鐛崘顭戞建闁逞屽墴瀵偊宕橀鑲╋紲濠电偞鍨堕懝楣冪嵁瀹ュ棔绻嗛柣鎰典簻閳ь剚鐗曠叅闁哄稁鐏涘☉妯锋婵﹩鍓欒ⅲ闂備線鈧偛鑻晶鎾煙椤旂瓔娈旈柍缁樻崌瀹曞綊顢欓悾灞兼喚闂傚倷娴囬~澶愭偤閺囩偐鏋嶉柡鍥ュ灩缁犵偤鏌曟繛鐐珔闁绘帒鐏氶妵鍕箳閹存繍浠鹃梺缁樻尪閸庤尙鎹㈠☉銏犵闁诲繑妞挎禍顏堛€侀弮鍫濈厸闁告劧绲芥禍鐐箾閸繄浠㈤柡瀣枎閳规垿鎮欑拠褍浼愬銈庡亜缁绘帞妲愰幒鎳崇喓鎷犲顔瑰亾閹剧粯鈷戦柛娑橈功閳藉鏌ㄩ弴妯哄姦鐎规洘娲熼獮妯肩磼濡攱瀚奸梻浣告啞缁哄潡宕曢崡鐐╂瀺闊洦绋掗悡鏇㈡倵閿濆簼绨绘い蹇e幗缁绘繈鍩€椤掍胶鐟归柍褜鍓欓~蹇涙惞閸︻厾鐓撻柣鐘充航閸斿孩瀵奸崶顒佲拺缂佸顑欓崕鎰版煟閳哄﹤鐏犻柣锝囧厴婵$柉顦抽柛鐘叉閺屾盯寮撮妸銉ョ濡炪倖姊瑰ú鐔奉潖閾忕懓瀵查柡鍥╁仜閳峰姊洪幐搴ゅ闁宠鍨块、姘跺幢濞戞瑯鈧秶绱撴担铏瑰笡闁烩晩鍨伴悾鐑芥偂鎼存ê鐗氶梺鍛婁緱閸ㄦ娊宕㈤鐐粹拻濞达絽鎲¢幆鍫ユ煟椤撶儐妲虹紒杈╁仦缁楃喖鍩€椤掑嫭鍋樻い鏇楀亾鐎规洖鐖奸、妤佸緞鐎n偅鐝濋梻鍌欒兌缁垰螞娴g硶鏋嶉柨婵嗩槸閻撴繈鐓崶銊﹀皑闁衡偓娴犲鐓熸俊顖濐嚙婢ь垶鏌涢悢椋庣闁哄本鐩幃鈺佺暦閸パ€鎷$紓鍌欑贰閸犳螞娓氣偓婵$敻骞囬弶璺唺闂佺鎻徊楣冨箟娴煎瓨鈷掑ù锝囨嚀椤曟粎绱掔€n偄鐏╅柍褜鍓氶崙瑙勭濠婂牆鐓濆ù鐘差儛閺佸倿鏌涢銈呮灁闁告﹢浜跺娲捶椤撶偘澹曢梺闈涙川閸嬬喖骞忕€n喖钃熼柕澶堝劤閿涙盯姊虹憴鍕妞ゆ泦鍛笉闁惧浚鍋傜换鍡涙煏閸繂顏柛蹇撶焸閺屾稑螣缂佹ê纾抽梺璇″枛閸㈡煡銈导鏉戠妞ゆ挾濮烽崢婊堟煟鎼淬値娼愭繛鍙夅缚閸掓帡骞樼紙鐘电畾濠殿喗绻傞惌鍫澪i崜褏纾藉ù锝嗗絻娴滅偓绻濋悽闈浶㈡繛璇х畵閹繝寮撮姀锛勫帗闂佸疇妗ㄧ粈渚€寮抽悢鍏肩厓闁芥ê顦藉Σ娲煟閵夘喕閭鐐叉椤т線鏌i幘鐐藉仮闁哄矉绱曟禒锕傚礈瑜夊Σ鍫ユ⒑鐎圭姵顥夋い锕傛涧閻g兘鏁撻悩鍐测偓鐑芥煕韫囨挻鍟為柛鈺傜洴濮婂宕掑▎鎺戝帯缂備緡鍣崹鎶藉极椤曗偓楠炴帒螖娴h鐝栭梻渚€娼чˇ顐﹀疾濞戞瑯鏀伴梻鍌欑閹测€趁洪敃鍌氬瀭闁规鍠氭稉宥呪攽閻樺磭顣查柛瀣剁秮閺屟嗙疀閺囩喎娈岄梺鍛婃煥椤戝寮婚敐鍡樺劅妞ゆ梻鍘х粻铏圭磽娴h櫣甯涚紒瀣崌閸┾偓妞ゆ帊鑳堕埊鏇炵暆閿濆懏鍋ラ柟顖氱灱閳ь剨缍嗛崜娑氬閸忕浜滈柡鍐ㄦ搐娴滃綊寮崼鐔虹瘈缁炬澘顦辩壕鍧楁煛娴g瓔鍤欓柣锝囧厴閹垻鍠婃潏銊︽珫婵犳鍠楁灙濞存粠鍓熷鍫曞箹娴e厜鎷绘繛杈剧到閹诧繝宕悙鐑樼厵闁告縿鍎遍崢鎾煙椤旀儳浠遍柡浣稿暣瀹曟帒顫濋幉瀣耿闂佽崵鍠愮划宀€鎹㈤幒鎳筹綁骞囬弶璺啋闁诲孩绋掗敋妞ゅ孩鎹囧娲川婵犲嫮鐣甸柣搴㈣壘閹虫ɑ淇婇悜钘夌厸闁稿本绮岄獮鍫ユ⒑鐠囨彃鍤辩紓宥呮瀹曟粌鈻庨幇顕呮祫闂佸憡顨堥崑鎰板绩娴犲鐓ユ繛鎴灻顏堟煛閸♀晛澧伴柍褜鍓濋~澶娒哄⿰鍫濈獥闁哄稁鍘归埀顑跨閳藉顫滈崱妯哄厞闂備胶枪缁绘宕戦幇顔剧煋闂侇剙绉甸埛鎺楁煕鐏炲墽鎳呮い锔肩畵閺岋綁濡堕崨顔芥倷闁捐崵鍋ら弻娑㈠即閵娿儮鍋撻悩娴嬫婵☆垶鏀遍悗濠氭⒑閸︻厼浜炬繛鍏肩懄缁傛帗绺介崨濞炬嫼缂傚倷鐒﹂敋闁诲繐宕埞鎴︻敊閸濆嫧鍋撳┑瀣槬婵炴垯鍨圭粻锝夋煥閺冨倹娅曢柛妯圭矙濮婅櫣绱掑Ο鑽ゅ弳闂佺顕滅槐鏇炩枎閵忋倕鐭楀璺侯槺缁犳岸姊洪崷顓犲笡閻㈩垪鏅犻幃鈩冪附閸涘﹦鍘搁悗鍏夊亾闁逞屽墴瀹曚即寮介鐐殿啇閻熸粎澧楃敮鈺呭极閸愵喗鐓忛煫鍥ㄦ礀椤庡本绻涢崗鑲╊暡濞e洤锕俊鍫曞炊椤喓鍎甸弻娑氣偓锝庡亞濞叉挳鎸婂┑瀣厽闁靛繒濮甸幉鍝モ偓瑙勬尫閻掞箓骞堥妸銉富閻犲洩寮撴竟鏇熶繆閻愵亜鈧垿宕瑰ú顏呭仭闁冲搫鎳庣粻鐘绘煛瀹ュ骸骞栭柣鎾寸☉閳规垿鎮╅幓鎺撴殬閻熸粌绉归崺鐐哄箣閿旇姤娅栭梺鍛婃处閸嬪倿寮堕銏♀拺缂佸灏呴弨濠氭煟濡ゅ啫孝闁伙絽鍢查埞鎴犫偓锝庡亝濞呭洭姊虹粙鎸庢拱婵ǜ鍔戦弫宥呪槈閵忊檧鎷虹紓浣割儐鐎笛冿耿閹殿喚纾兼い鏃囧亹鏁堥梺鎸庣箘閸嬨倕顕i幘顔藉亜闁告挷鑳堕悾楣冩⒒娓氣偓濞佳囨偋閸℃瑢鍋撳鐓庣仸鐎规洘顨呴悾婵嬪焵椤掑倹顫曢柟鐑橆殔閻撱垽鏌嶈閸撶喎鐣烽幋锕€绠荤紓浣骨氶幏缁樼箾鏉堝墽鍒版繝鈧崡鐑囪€垮ù鐘差儐閻撴洟鏌曟繛鍨妞ゃ儱顦悾婵嬫晲閸繂濮峰銈忛檮閻擄繝寮婚敓鐘插耿闊洦姊归悵姘攽椤旂》鍔熺紒顕呭灦楠炲繘宕ㄧ€涙ê娈熼梺闈涱檧缁叉椽宕戦幘璇茬妞ゅ繐妫涢敍婊堟⒑闁偛鑻晶顖滅磼濡ゅ啫鏋涢柛鈹惧亾濡炪倖甯掔€氼喖鐣垫担鍓茬唵闁兼悂娼ф慨鍫ユ煛閸涱喗鍊愰柡宀嬬到铻i柛顭戝枤濮c垽姊哄Ч鍥р偓鏇犫偓姘緲椤繐煤椤忓拋妫冨┑鐐寸暘閸庨亶鎮ч幘鎰佸殨闁圭粯宸诲Σ鍫熸叏濡搫缍佺紒妤€顦辩槐鎾诲磼濞嗘垵濡介柤鍨﹀厾鐟扳堪閸曨厾鐓夐梺鍝勭焿缁绘繂鐣峰鈧俊鎼佹晝閳ь剟藝閳轰緡娓婚柕鍫濆暙閸旀碍銇勯敂鐐毈鐎殿喛顕ч埥澶愬閻樻鍟岄梻浣告啞濞诧箓宕归柆宥庢晛鐎广儱娲ㄧ壕钘壝归敐鍫燁仩閻㈩垱绋撶槐鎺旀嫚閼碱剙顤€闂侀€涚┒閸旀垿宕洪埀顒併亜閹烘垵顏柣鎾卞劜缁绘繈妫冨☉娆樻!闂侀潻绲肩划娆撳蓟濞戞﹩娼ㄩ柛鈩冦仦閸犲﹤鈹戦纭锋敾婵$偠妫勯悾鐑藉Ω閿斿墽鐦堥梺鍛婂姧缁插墽鈧氨绮换婵嬫偨闂堟稐绮堕悗娈垮枛閻栧ジ骞冭瀵挳鎮╅幓鎺旀煣闂傚倸鍊烽懗鍫曪綖鐎n喖绀嬮柛顭戝亞閺嗭箓姊绘担鐟扳枙闁衡偓鏉堚晜鏆滈柟鐑橆殕缁犳帡姊绘担鐟邦嚋缂佽鍊块獮濠呯疀濞戞ḿ鏌堥梺缁樺姉閸庛倝鎮¢弴銏$厽闁哄倹瀵ч幆鍫澝归悪鍛洭缂佽鲸甯炵槐鎺懳熺粭琛″亾閹烘鐓欏瀣闉嬪銈忛檮閹告娊寮婚敐澶嬫櫜闁搞儯鍔嶅В鍕⒑闁偛鑻晶鍙夈亜椤愩埄妲搁悡銈嗘叏濡炶浜鹃悗瑙勬礀缂嶅﹤鐣疯ぐ鎺濇晩闁绘劦鍓氶鏇㈡⒒娓氣偓濞佳嗗闂佸搫鎳忕粙鎾绘儉椤忓浂妯勯梺鍝勭灱閸犳捇鍩€椤掑倹鏆╅弸顏呫亜鎼淬垺灏电紒杈ㄥ笚濞煎繘鍩¢崒娑欑槗婵犳鍠栭敃锔惧垝椤栫偛绠柛娑樼摠閸婄粯淇婇婊冨妺闁伙綆鍓欓埞鎴︽偐椤愶絽顎忛梺鍛婁緱閸犳鎮甸鍫熲拺闁告稑锕ょ粭姘舵偨椤栥倗绡€闁靛棔绀侀埥澶愬閳ユ枼鍋撻悜鑺ョ厾缁炬澘宕晶顔筋殽閻愯尙澧︽慨濠勭帛閹峰懘宕ㄦ繝鍛攨闂備胶枪缁ㄦ椽宕愬┑鍡欐殾闂傚牊渚楀ḿ鈺呮煟閹邦厼鐏婃慨瑙勵殜濮婃椽宕烽鐐插闂佽鐡曢褔鍩㈠鍛牚闁割偆鍟块幏娲⒑绾懎浜归柛瀣洴瀹曟繂螖閸涱喚鍘搁梺鍛婁緱閸犳岸鎯岄幒鎿冩闁绘劕妯婂Σ鍛娿亜椤愶絿鐭掗柛鈹惧亾濡炪倖宸婚崑鎾淬亜椤愩垻绠伴悡銈嗐亜韫囨挸顏い鏃€鍔欏铏圭磼濡搫顫嶇紓浣风劍閹稿啿鐣烽幋锕€绠婚悹鍥ㄥ絻瀹撳棝姊洪棃娑氱濠殿喚鍏樺濠氬醇閵夛腹鎷洪梺闈╁瘜閸欌偓婵$偓鎮傞弻娑㈡偐瀹曞洤鈷岄梺褰掓敱閸ㄥ潡骞冮姀銈呬紶闁靛/灞芥櫗闂傚倷鑳堕幊鎾绘偤閵娾晜鍋¢柕澶嗘櫆閸婅埖銇勮箛鎾跺闁绘挻鐩弻娑樷槈閸楃偞鐏撻梺鍛婄憿閸嬫挻淇婇妶鍥ラ柛瀣仱閹冣堪閸繄顦梺鍦劋椤ㄥ棝宕戦敓鐘崇厸濠㈣泛锕﹀銊╂煙閺嬵偄鈧繂顫忕紒妯诲闁惧繒鎳撶粭锛勭磽娴g瓔鍤欓柛鐔跺嵆楠炴垿濮€閵堝懘鍞堕梺闈涱槶閸庢娊鎮鹃崫鍕ㄦ斀閹烘娊宕愰弴銏犵柈妞ゆ牜鍋涚粣妤呮煕閳╁啰鈯曢柣鎾存礋閺岋繝宕堕妷銉ヮ瀳婵犫拃鍛暭闁靛洤瀚伴弫鍌炲传閸曨偒鐎寸紓鍌欒兌缁垳鎹㈤崼銉ョ畺濞寸姴顑嗛ˉ鍫熺箾閹寸儐娈橀柟瑙勬礋濮婄粯鎷呴悷閭﹀殝濠电偠顕滈梽鍕矉瀹ュ應鍫柛顐亝閺咁亪姊洪幐搴g畵妞わ缚绮欏顐﹀礃椤旂晫鍙嗛梺鍝勬处椤ㄥ懏绂嶉崜褏纾藉ù锝呮惈鏍$紓浣割儐鐢剝淇婇悽绋跨妞ゆ牗姘ㄩ鎺楁煟閻樿崵绱版俊妞煎姂楠炲顦版惔锝囷紳婵炶揪绲块幊鎾存叏婢舵劖鐓曢悗锝冨妼閳ь剚娲熼敐鐐剁疀閹句焦妞介、鏃堝礋椤撗勑ら梻鍌欑濠€杈╁垝椤栨粍鏆滃┑鐘插婵啿鈹戦崒姘暈闁抽攱鍨块弻锝夊箻閸愬樊鍔夐柣鐘冲姧缁绘繈寮诲☉姘e亾閿濆骸浜濋悘蹇曟暩缁辨帡顢欑喊鍗炲壈濡炪倖鎸搁崥瀣嚗閸曨剛绡€闁告洦鍘藉В搴♀攽閿涘嫬浜奸柛濞垮€濆畷妤€顫滈埀顒勫春閳ь剚銇勯幒鍡椾壕缂佸墽铏庨崢鍓у垝閺傛5娲敂閸涱垰骞愬┑鐐舵彧缁插潡骞婇幘瀛樺弿鐎广儱娲犻崑鎾舵喆閸曨剛顦梺鍛婎焼閸パ呭幋闂佺鎻粻鎴犵矆閸愵喗鐓忓┑鐐茬仢閳ь剚娲熻棢婵﹩鍏橀弨浠嬫煟閹邦剚鈻曢柛銈囧枎閳规垿顢欓懞銉ュ攭濡炪們鍨洪悧鐘茬暦閸楃偐妲堟俊顖溿€嬬槐閬嶆⒒娴e憡鍟炴繛璇х畵瀹曞綊鏌嗗鍡椾簵闂佺粯鏌ㄩ崥瀣偂濞嗘挻鍊甸柣銏犳啞濞呮粎绱掓潏顐g彧闁靛洤瀚粻娑㈠箻閺夋垶顏ゆ俊鐐€愰弲婵嬪礂濮椻偓瀵鎮㈤崗鐓庘偓缁樻叏濡も偓濡瑩鎮鹃悜鑺モ拺闁规儼濮ら弫閬嶆煕閵娿儲鍋ョ€殿喖顭烽弫鎾绘偐閼碱剨绱叉繝纰樻閸ㄤ即骞栭锝嗗弿闁哄洨鍋愰弨浠嬫煟閹邦剙绾ч柛锝呯秺閺岀喖鎼归顒冣偓璺ㄢ偓娈垮枦椤曆囧煡婢舵劕顫呴柍銉ュ帠缁ㄨ棄鈹戦悙鑸靛涧缂佽弓绮欓獮妤€饪伴崟顓ф祫闂佸綊妫块悞锕傚磹閸偆绠鹃柛顐g箘娴犮垽鏌$€n偆娲撮柡宀嬬秮瀵€燁槹闁稿鍨介弻锝呪槈閸楃偞鐝濋悗娈垮枙缁瑦淇婇幖浣规櫇闁逞屽墴椤㈡捇骞樼紒妯锋嫼缂備礁顑堝▔鏇犵不閻楀牄浜滈柨鏃囨椤ュ鏌嶈閸撴岸鎳濇ィ鍐ㄎх紒瀣儥濞兼牗绻涘顔荤凹闁搞倖甯¢弻鏇㈠醇濠靛洤鏅介梺闈涢獜缁辨洜绮绘ィ鍐╁仯闁搞儱娲ら幊鎰板汲閵忋倖鈷戦梻鍫熺⊕婢跺嫰鏌涢弮鈧悷銉╂偩瀹勯偊娼ㄩ柍褜鍓熼妴浣糕枎閹炬潙浜楅柟鍏肩暘閸ㄥ綊宕濋幒妤佲拻濞达絽鎲¢幆鍫熴亜閿旇鐏﹂柟顔ㄥ洤绀冩い鏃囧亹閺屟冣攽閻樼粯娑ч柣妤€妫濊棢婵ǹ鍩栭悡鐔兼煥濠靛棙鍣规い锔诲墴閺屾稓鈧綆鍋呭畷宀勬煟濞戝崬娅嶇€规洖缍婇、娆撴偂鎼搭喗缍撻梻鍌氬€烽懗鍫曞箠閹捐鐤悹鎭掑妽瀹曞弶淇婇娑橆嚋闁挎稑鍊垮缁樼瑹閳ь剙岣胯閹广垽宕卞☉妯肩枃闂佹悶鍎洪崜娆戝婵犳碍鐓欓柟瑙勫姇閻撴劙鏌涢悩鍙夘棦闁哄本鐩鎾Ω閵夈儺娼炬俊鐐€х拹鐔煎礉閹存繍娼栨繛宸簻缁犲綊鏌i幇顓炵祷妞ゎ剙鐗撳铏规嫚閼碱剛顔夌紓浣筋嚙閻楁捇鐛崘鈹垮亝闁告劏鏅涢埀顒€顭烽弻锕€螣閻氬绀嗛梺鍐叉惈閸燁垶宕伴幇顒夌唵闁兼悂娼ф慨鍥╃棯閹岀吋闁哄瞼鍠栭幃娆擃敆娴h桨绱樻繝纰樺墲瑜板啴鎮ф繝鍕床婵炴垯鍨瑰钘壝归敐鍤藉湱鈧冻绲剧换娑氣偓娑欋缚閻绱掔拠鎻掝伀闁告帗甯為埀顒婄秵閸犳牜绮婚幎鑺ョ厵闁诡垎鍛厽濠碉紕铏庨崳锝咁潖濞差亜宸濆┑鐘插濡插牓鏌ら悷鎵劯闁哄瞼鍠栭弻銊р偓锝庡亖娴犮垹鈹戦纭锋敾婵$偠妫勯悾鐑藉Ω閿斿墽鐦堥梺鍛婂姂閸旀垿鎮楀ú顏呯厽闁绘柨鎽滈惌瀣節閵忊槄鑰跨€规洦鍨堕、娑樷堪閸涱垳鍔归柣搴$畭閸庨亶骞婃径鎰哗濞寸姴顑嗛悡鏇㈡煏婢跺牆鐏繛鍛处閵囧嫰寮埀顒€煤閻斿娼栨繛宸簻瀹告繂鈹戦悩鎻掝仾闁革急鍐炬富闁靛洦澧庨崑鎾绘煕鐎n偅宕屾慨濠冩そ瀹曟宕楅懖鈺佸殥婵犵數鍋熼妴瀣崲濠靛棭鍤曢悹鍥ㄧゴ濡插牓鏌曡箛鏇炐ラ柛妯绘倐濮婅櫣绮欓幐搴㈡嫳缂備緡鍠栫粔鐟扮暦濮橆兘妲堟俊顖涚矋濡啴骞冮埡鍛棃婵炴垶顨嗛崟鍐⒑濮瑰洤鐒洪柛銊ф櫕閹广垹鈹戠€n偄浠掑銈嗘⒒閺咁偆寮ч埀顒勬⒑閹肩偛鍔撮柣蹇旂洴閸╋繝宕ㄩ鎯у妇濠电姰鍨奸鏍垂娴兼潙绠熸繛鎴欏灩鎯熼梺鍐叉惈閸婄敻骞忓ú顏呯厸濠㈣泛鑻禒锕€顭块悷鐗堫棦鐎规洘绻傞鍏煎緞鐎n剙骞堥梻浣告惈閸熺娀宕戦幘缁樼厽闁绘梹娼欓崝锕傛煙椤曗偓缁犳牠骞冨⿰鍫熷癄濠㈠厜鏂侀弲鐘诲蓟瀹ュ浼犻柛鏇″煐閺侀箖姊洪崫鍕櫝闁哄懐濮撮~蹇涙惞閸︻厾鐓撻柣鐘充航閸斿酣顢欓崶顒佲拺闁告稑锕ㄦ竟妯汇亜閹存繍妯€妤犵偛鍟撮幃娆擃敆閸岀偞顎嶉梻浣告啞缁嬫垼澧濋梺鐟板槻椤嘲顫忛搹鍦煓闁圭ǹ瀛╅幏閬嶆⒑閼姐倕娅愬┑鈥虫川閸掓帗绻濋崶銊ヤ罕闂佸壊鍋呯粙鎰姳婵犳碍鈷戦柛婵嗗瀹告繈鏌涢悩铏鞍闁哄懎鐖奸幃鐣屽枈濡桨澹曢柣鐔哥懃鐎氼厾绮堟径瀣ㄤ簻妞ゆ劑鍩勫Σ娲煃瑜滈崗娑氬緤婵犳艾纾婚柟鐗堟緲閻掑灚銇勯幒宥堝厡闁愁垱娲熼弻銊ヮ潩椤戠偟鎳撻オ浼村幢濞戞ɑ鎳欑紓鍌欒兌缁垳鎹㈤崼銉ョ畺濞寸姴顑嗛ˉ鍫熺箾绾惧鍫柛銊ㄦ閹广垹鈽夊顐e媰闂佺ǹ鏈崺鍐磻閹捐鍐€妞ゆ挻澹曢崑鎾存媴閸︻厾鐦堥梺鎼炲劘閸斿骞忕紒妯肩閺夊牆澧介崚浼存煙鐠囇呯瘈鐎规洦鍨堕幃娆戔偓闈涙憸椤旀洟鏌i悩鍙夊巶闁告侗鍨卞▓濂告煟鎼淬値娼愭繛鍙壣戠换娑欑節閸ャ儮鍋撴担绯曟瀻闁规儳鍟跨花銉︾節閵忥絽鐓愮紒瀣尵缁棃顢氶埀顒勫蓟閻旂⒈鏁婇柣锝呯灱閻撳姊洪悷鎵紞闁稿鍊栨穱濠囨倻閽樺娼婇梺鐐藉劜閸撴碍瀵奸弽顐ょ=闁稿本鑹鹃埀顒佹倐瀹曟劖顦版惔锝囩劶婵炴挻鍩冮崑鎾淬亜閵忥紕澧电€规洖宕埥澶嬫綇閵婏附鐝楀┑鐘垫暩閸嬫稑螞濞嗘挸绠伴柛婵勫劚椤ユ岸鏌涜椤ㄥ棝鎮″▎鎾寸厵婵炲牆鐏濋弸娑欍亜閿濆懌鍋㈤柡宀嬬秮楠炴ḿ鈧潧鎲¢崳浼存⒑閸濆嫮鐒跨紓宥勭窔楠炲啴濮€閵堝懍绱堕梺鍛婃礀閻忔艾袙婢舵劖鈷掑ù锝囧劋閸も偓闂佸憡鑹鹃澶婄暦濠靛鍐€妞ゆ挾鍊i敃鍌涚厱闁哄洢鍔岄悘閬嶆煛娴gǹ鏆i柡灞炬礉缁犳稓鈧綆浜炴导鍕渻閵堝棙鐓ユ繛宸弮瀵鏁愭径濠勵啋闂佸憡顨堥崑鎰板磻閹捐鍐€妞ゆ挾鍊i敃鍌涚厱闁哄洢鍔岄弸銈夋煟閵堝倸浜鹃梻鍌欑濠€閬嶅磻閹剧繀缂氭繛鍡楃箚閺嬪秹鏌ㄥ┑鍡橆棤缂佺娀绠栭幃妤呮偨閻ц缍婇、鎾崇暆閸曨剛鍘卞┑鐐叉缁绘劙寮冲▎鎰╀簻妞ゆ劑鍨荤粻浼存偂閵堝棎浜滈煫鍥ㄦ尭椤徰呯磼閸楃偟鍩f慨濠冩そ瀹曘劍绻濋崘顏嶆К闂備浇顕х换鎴犲枈瀹ュ鐤鹃柕澶嗘櫆閳锋帒霉閿濆洨鎽傞柛銈嗙懄缁绘稓鈧數枪閸樻挳鏌熼鎯у幋妤犵偛閰i幐濠冨緞鐏炶В鍋撻悙鐑樷拺闁兼祴鏁氳ぐ鎺撳€舵慨姗嗗厴閺嬪秹鏌熼崜褏甯涢柍閿嬪笒閵嗘帒顫濋敐鍛闂備線鈧偛鑻晶浼存煕鐎n偆娲撮柟宕囧枛椤㈡稑鈽夊▎鎰娇闂佽瀛╃粙鎺曟懌闂佸憡鐟ョ换鎰板煘閹达附鍋愰柟缁樺俯娴尖偓闂佹眹鍩勯崹閬嶆儎椤栫偛钃熼柣鏃堫棑閺嗗鏌eΔ鈧悧鍡椻枔濡ゅ懏鈷戦悹鍥b偓铏亶缂備緡鍠栭惌渚€鎮橀幒妤佲拺缂備焦锚閻忥箑鐣濋敐鍛仴鐎殿喖鍟块~婵嬫嚋绾版ɑ瀚介梻浣呵归張顒勬偡瑜斿畷婵嗩吋婢跺鍘靛銈嗘閸嬫劙宕洪敐鍥e亾鐟欏嫭绀冮柛鏃€鐟ラ锝嗙鐎e灚鏅i梺缁樻濞撳湱绱旈弴銏♀拻濞达綀娅g敮娑㈠几椤忓棌鍋撶憴鍕婵炰匠鍥ㄥ仼闁割煈鍋嗛悷褰掓煃瑜滈崜鐔煎箖閿熺媭鏁冮柨鏇楀亾闁绘劕锕弻鏇熺箾瑜夐崑鎾斥攽椤斿吋鍠樻慨濠冩そ瀹曨偊宕熼鈧▍銈夋⒑鐠団€虫灈闁稿﹤鐏濋锝嗙節濮橆儵鈺呮煃閸濆嫬鈧憡绂嶉悙鐑樷拺缂佸瀵у﹢鎵磼鐎n偄鐏存い銏℃閺佹捇鏁撻敓锟�/闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ょ紓宥咃躬瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁绘劦鍓欓崝銈囩磽瀹ュ拑韬€殿喖顭烽幃銏ゅ礂鐏忔牗瀚介梺璇查叄濞佳勭珶婵犲伣锝夘敊閸撗咃紲闂佽鍨庨崘锝嗗瘱闂備胶顢婂▍鏇㈠箲閸ヮ剙鐏抽柡鍐ㄧ墕缁€鍐┿亜韫囧海顦﹀ù婊堢畺閺屻劌鈹戦崱娆忓毈缂備降鍔岄妶鎼佸蓟閻斿吋鍎岄柛婵勫劤琚﹂梻浣告惈閻绱炴笟鈧妴浣割潨閳ь剟骞冨▎鎾崇妞ゆ挾鍣ュΛ褔姊婚崒娆戠獢婵炰匠鍏炬稑鈻庨幋鐐存闂佸湱鍎ら〃鎰礊閺嶃劎绡€闂傚牊渚楅崕鎰版煛閸涱喚鍙€闁哄本绋戦埥澶愬础閻愬樊娼绘俊鐐€戦崕鏌ユ嚌妤e啫鐓橀柟瀵稿仜缁犵娀姊虹粙鍖℃敾妞ゃ劌妫濋獮鍫ュΩ閳哄倸鈧鏌﹀Ο渚Ш闁挎稒鐩铏圭磼濡搫顫庨梺绋跨昂閸婃繂鐣烽幋鐘亾閿濆骸鏋熼柣鎾跺枑娣囧﹪顢涘┑鍡楁優濠电姭鍋撳ù鐘差儐閻撳啰鎲稿⿰鍫濈婵炴垶纰嶉鑺ユ叏濮楀棗澧婚柛銈嗘礋閺屸剝寰勭€n亞鍔稿┑鐐茬毞閺呯姴顕i崼鏇為唶婵﹩鍘藉▓銊╂⒑闂堟稓绠為柛濠冪墵閸╂盯骞掗幊銊ョ秺閺佹劙宕奸锝囩Х闂備胶枪椤戝洦绻涢埀顒勬煛鐏炲墽鈯曢柟顖涙婵偓閹鸿櫕绂掗姀銈嗗€甸悷娆忓缁€鍐磼椤旇姤宕岀€殿噮鍋婂畷姗€顢欓懖鈺嬬床婵犳鍠楅敃鈺呭储妤e啫鐒垫い鎺戭槸婢у瓨鎱ㄦ繝鍐┿仢鐎规洏鍔嶇换婵嬪磼濮f寧娲熷娲传閵夈儛锝嗐亜閵娿儻韬鐐插暣閺佹捇鎮╅崣鍌樺姂閺屽秹宕崟顐熷亾婵犳艾鍌ㄩ柟闂寸劍閳锋垿鏌熼懖鈺佷粶闁告梹鎸抽弻锝夊箻瀹曞洤顣洪梺宕囩帛閹瑰洤顕i鈧灋闁汇垹鐏氶崵鈧Δ妤婁簷閸楀啿鐣锋總绋款潊闁靛繆鍓濋惁鎺戔攽閻樻剚鍟忛柛鐘崇墵閺佸啴濡舵径濠勵啇濡炪倖鍔х徊鎯р枍韫囨稒鈷掑ù锝堫潐閸嬬娀鏌涙惔銏㈢煉闁糕斁鍋撳銈嗗笒鐎氼剛澹曟繝姘厵闁绘劦鍓涚粣鐐烘煛閸愩劎澧曠€瑰憡绻冮妵鍕箻鐠轰警鈧挾绱掗柆宥勬喚婵﹦绮幏鍛驳鐎n偆绉烽柣搴ゎ潐濞叉﹢鏁冮姀鐘垫殾婵炲樊浜滈崘鈧悷婊冪箻瀵娊鏁冮崒娑氬幈濠电偛妫楀ù姘i搹鍦<闁抽敮鍋撻柛瀣崌濮婂宕掑顑藉亾閹间焦鍋嬪┑鐘插閻瑩鏌熼悜妯虹劸闁哥喎鎳忕换婵嬫濞戞艾鈪辩紒鐐劤閵堟悂寮诲澶嬬叆妞ゆ牗鐭竟鏇㈡⒒娴e懙褰掝敄閸℃稑绠查柛銉戝本缍庣紓鍌欑劍钃卞┑顖涙尦閺屾稑鈽夐姀鈩冮敪缂傚倸绉撮敃銈夘敋閿濆鍋ㄩ柛鎾冲级閺呫垽姊虹粙鎸庢拱缂侇喖閰i幃锟犲箻缂佹ǚ鎷洪梺鑽ゅ枑婢瑰棝骞楅悩鐢电<婵炲樊浜為悾铏光偓娈垮枤鏋い鎾冲悑瀵板嫮鈧綆鍓欑敮楣冩⒒娴gǹ顥忛柛瀣噽閹广垹顓奸崨鍌︾秬閵囨劙骞掗幘璺哄箞濠电姷鏁告慨瀵糕偓姘煎弮瀵娊顢楅崟顒傚幍濡炪倖姊婚崢褍危婵犳碍鐓冮悹鍥у级閸炲绱掗悩宕囨创妤犵偞鐟╁畷妯款槾婵☆偒鍨崇槐鎾诲磼濮橆兘鍋撴搴㈠闁哄被鍎辩壕濠氭煙閸撗呭笡闁绘挻娲熼弻鐔稿鐎涙ɑ閿梺鍝勵儑閸犳牠寮婚敐澶婄閻犺櫣鍎ら悘鍫ユ⒑閸濆嫮鐏遍柛鐘崇墪閻g柉銇愰幒婵囨櫓缂佺偓婢樿ぐ澶屾閹寸姷纾介柛灞剧懆椤斿淇婇悪娆忔搐绾惧鏌熼崜褏甯涢柣鎾跺枛楠炴牕菐椤掆偓閻掓椽鏌涢悢椋庣闁哄本鐩幃鈺佺暦閸ャ劌鍨辨俊鐐€戦崹鐑樼┍濞差€洩銇愰幒鎾跺幈闂佸磭鎳撻悘婵嬪礉濠婂應鍋撻崹顐g凡閻庢矮鍗抽悰顕€宕堕澶嬫櫌婵犮垼娉涢鍥╃矓闁秵鈷掗柛灞剧懆閸忓瞼绱掗鍛仩闁绘粌顭峰畷绋课旈埀顒勫几娓氣偓閺岀喖姊荤€靛壊妲紓浣哄珡閸ャ劎鍘甸梻鍌氬€搁顓㈠礉瀹ュ鐓冮梺鍨儏缁楁帡妫佹径鎰叆婵犻潧妫欓崳娲煕閵堝懐澧﹂柡灞剧洴閺佸倻鎷犻幓鎺旑啈闁诲氦顫夊ú姗€鎮¢敓鐘茶摕闁绘柨鍚嬮崑瀣煕椤愩倕鏋旈柛鎴磿缁辨挻鎷呴崫鍕戙儵鏌涙惔娑樷偓妤呭箲閵忕姭鏀介柛銉㈡櫇閻﹀牓姊虹粙鎸庢拱缂侇喖鐭傞妴鍌炴惞閸︻厾锛濇繛杈剧稻瑜板啯绂嶆ィ鍐┾拺闁告稑锕ユ径鍕煕濡湱鐭欑€规洑鍗抽獮鍥偋閸垹骞楁繝寰锋澘鈧劙宕戦幘缁樼厽婵°倐鍋撴俊顐g〒閸掓帡顢橀悜鍡樺兊闂佺厧鎽滈弫鎼佸储閹剧粯鈷掑ù锝呮憸娴犮垺銇勯幋婵囧殗闁诡喗锕㈤崺锟犲礃椤忓棴绱查梺鍝勵槸閻楀嫰宕濆畝鈧划顓☆樄闁哄苯绉烽¨渚€鏌涢幘鍗炲缂佽京鍋ゅ畷鍗炩槈濡搫浜堕梻浣风串缁蹭粙寮甸鍕婵犲﹤鐗婇悡鏇㈡煙閹规劕钄奸柛蹇撶灱閻ヮ亪骞嗚閸嬨垽鏌″畝瀣埌閾伙綁鏌i幋鐐嗘垿宕曢幘缁樷拺婵懓娲ゆ慨鈧┑鐐叉嫅缁插灝危閹版澘绠抽柟鎯ь嚟缁夊爼姊洪棃娴ㄥ綊宕曢懠顒佸珰闁绘劕妯婂〒濠氭煏閸繂鏆欓柣蹇d邯閺岋綁鎮㈤崣澶嬬彋濡ょ姷鍋涢敃顏堝箖濞嗘挸浼犻柛鏇炵昂閸旀垿寮婚弴鐔虹彾妞ゆ牗姘ㄨ倴婵犮垼娉涚€氭澘顫忕紒妯诲缂佹稑顑呭▓顓㈡煟鎼淬垻鈻撻柡鍛█閵嗕礁鈻庨幘鍐插敤濡炪倖鎸鹃崑鐔兼偘閵夆晜鈷戦柛婵嗗閳诲鏌涘Ο缁樺€愰柛鈹惧亾濡炪倖甯掗敃锕傛偩閻㈠憡鐓涢悘鐐额嚙婵″潡鏌嶈閸撱劎寰婂ú顏勭柧婵犻潧鐗忔稉宥嗘叏濡灝鐓愰柍閿嬪灴閺屾盯骞橀弶鎴犵シ婵炲瓨绮嶇换鍐崲濞戙垹鐭楀璺鸿嫰閳峰矂姊虹拠鈥虫灍闁荤噦濡囬幑銏犫攽鐎n亞鍊為梺闈浤涢崘銊х懖闂傚倸鍊风粈渚€骞夐敍鍕床闁稿本澹曢崑鎾愁潩閻撳骸鈷嬮悗娈垮枟婵炲﹪骞冮姀銈呯闁兼祴鏅涢獮鍫熺節濞堝灝鏋熸い銊ユ噹铻炴俊銈呮噺閸婂爼鏌ㄩ弮鍥撻柛娆忕箰閳规垿鎮╅幓鎺撴闂侀潧娲︾换鍫ュ蓟閻旇櫣椹抽柛锔诲幘閻﹀牊绻濈喊妯峰亾瀹曞洤鐓熼悗瑙勬磸閸旀垵鐣烽鍫濈妞ゅ繐瀚悡鍌炴⒒閸屾碍鎼愭い锔藉閹广垹鈹戦崶鈺冾啎闂佽鍨庨崒姘兼缂傚倸鍊搁崐椋庢閿熺姴绐楁俊銈呮噺閸嬶繝鏌曟径鍡樻珕闁稿鏅濋埀顒傛嚀鐎氼厽绔熺€n喖缁╁ù鐘差儐閻撴洘銇勯幇鍓佺К濠㈣锚闇夋繝濠傜墢閻f椽鏌$仦璇插闁宠鍨垮畷鍗炩槈閹典礁浜炬俊銈傚亾妞ゎ叀鍎婚¨渚€鏌涢敐蹇曠М鐎殿喛顕ч埥澶愬閻樻牑鏅犻弻銊╁棘閸喒鎸冮梺姹囧€曠€氭澘顫忓ú顏勪紶闁告洦鍓氶幏閬嶆⒑閻戔晜娅撻柛銊ョ埣瀹曡銈i崘鈺傛珖闂佺ǹ鏈銊╊敇閸濆嫧鏀介柣妯肩帛濞懷囨煙閾忣偄濮嶇€殿噮鍋婂浠嬵敃閵堝浄绱抽梻浣呵归張顒勬偡閵娾晛绀傞悘鐐缎掗弨浠嬫煟閹般劍娅呭ù婊冨⒔缁辨捇宕掑▎鎺戝帯婵犳鍠氶弫濠氬箖瑜旈幃鈺呮嚒閵堝懐銈﹂梻浣告啞閸旀垿宕滈鈧顕€宕煎┑鍫濆Е婵$偑鍊栫敮鎺斺偓姘煎墴閹繝鍨鹃幇浣哄數闁荤姴鎼ぐ鍧楀醇閵夈儱鍤戦悗骞垮劚濡孩绂嶅⿰鍫熺厵闁绘劦鍓﹀▓鏃堟煕婵犲偆鐓奸柟顖氬閹棃濡搁敂瑙勫闁诲氦顫夊ú鏍洪妸褎鏆滄繛鎴欏灪閻撴瑩鏌i悢鍝勵暭闁哥姵蓱椤ㄣ儵鎮欓幓鎺撴闂佺硶鏅换婵嗙暦濮椻偓椤㈡棃宕遍鐘茬哎婵犵數濮烽。钘壩i崨鏉戝瀭闁规儼妫勯崒銊ф喐閺冨牊鍋樻い鏇楀亾鐎规洜鍘ч埞鎴﹀礃閳哄倹婢戦梻鍌欒兌缁垶鏁嬮梺璇茬箲瀹€绋款嚕閹惰棄鐓涘ù锝呭级閺傗偓婵$偑鍊栧Λ浣规叏閵堝洣鐒婇柨鏃堟暜閸嬫挾鎲撮崟顒€顦╅梺鎼炲妼閻栧ジ鐛崘顓ф▌閻庤娲栭妶鎼佸箖閵忋倕浼犻柕澶堝劚閳诲繘姊婚崒姘偓鎼佸磹妞嬪孩顐介柨鐔哄Т缁€鍫熺箾閸℃ê鐏╅柣顓熸崌閺岋綁濮€閻樺啿鏆堥梺绋款儏閸婂湱鎹㈠☉銏犲耿婵☆垰鎼婵犵數鍋涢悧鍛垝濞嗘挸钃熼柨婵嗩槸缁犳稒銇勯弽銊︾殤婵絻鍨虹换娑氣偓鐢登硅ⅷ闂佹悶鍔嬬划娆忣嚕婵犳碍鏅查柛顐犲灮閺夊憡绻濋悽闈浶㈤柛鐕佸灦閹潧顫濋懜纰樻嫼闂佸憡绻傜€氼垳鈧碍澹嗙槐鎺撳緞婵犲嫬鐓熷Δ鐘靛仜椤︾敻鐛鈧、娆撴嚃閳哄﹥效濠碉紕鍋戦崐鏍礉閹达箑纾归柟鎹愵嚙缁犳牠鏌ㄥ┑鍡╂Ч闁抽攱甯掗妴鎺戭潩閿濆懍澹曢梻渚€鈧偛鑻晶浼存煕鐎n偆娲撮柟宕囧枛椤㈡稑鈽夊▎鎰娇闂備礁鎲¢幐鍡涘川椤栥倗闂梺璇查缁犲秹宕曢柆宥呯疇闊洦铔嬫径鎰潊闁冲灈鏅涙禍楣冩偡濞嗗繐顏紒鈧崘顔界厱闁靛ǹ鍎查崑銉╂煟濞戝崬娅嶆鐐村笒铻栭柍褜鍓涚划濠氭偐缂佹ḿ鍙勯棅顐㈡祫缁茶姤绂嶉悙瀵哥闁圭粯甯╅崵鐔兼煃瑜滈崜婵嬶綖婢跺⊕鍝勵潨閳ь剟寮崘顔碱潊闁炽儴灏欑粻姘舵⒑瑜版帗锛熺紒鈧笟鈧敐鐐哄川鐎涙ḿ鍘撻梺瀹犳〃缁€渚€寮抽悙瀵哥瘈闁靛繆鈧磭浼屽┑顔硷工椤嘲鐣烽幒鎴旀瀻闁圭儤鍨电敮顖滅磽閸屾瑧璐伴柛锝庡櫍瀹曞湱鎹勯搹瑙勬濠电娀娼ч鍛村礃閳ь剟姊洪崹顔剧伇缂佽鲸鎸搁~婵嬵敇閻樻鍟庨梻浣虹《閸撴繆鎽柣蹇撶箣閸楁娊寮诲☉娆戠瘈闁稿本绮岄悡鐔兼⒑閸濆嫯顫﹂柛鏃€鍨甸锝夊箻椤旇棄鈧攱绻涢弶鎴剰濞存粌澧介幉鎼佹偋閸繄鐟ㄧ紒鐐劤椤兘寮婚弴鐔虹瘈闊洦姘ㄩˇ鐗堢箾鐎涙ḿ鐭嬬紒顔芥崌瀵鍨鹃幇浣告倯闂佸憡鍔戦崝宀勨€栫€n喗鈷戞繛鑼额嚙楠炴牠鏌ㄩ弴妯衡偓婵嗭耿娓氣偓濮婅櫣绱掑Ο蹇d簽婢规洟顢橀姀鈥冲壒闂佸湱鍎ら〃鍡涙偂濞戙垺鍊堕柣鎰邦杺閸ゆ瑥鈹戦鐓庘偓濠氬焵椤掍緡鍟忛柛鐘愁殔宀e灝鈻庨幒鏂捐埅闂傚倷鐒﹂崕宕囨崲濮椻偓閸┾偓妞ゆ帊鑳堕妴鎺旂磼閳ь剟宕熼娑掓嫼闁荤姴娲ゅ鍫曞船婢跺浜滄い鎰╁焺濡叉悂鎮¢妶澶屽彄闁搞儯鍔庨埥澶岀磼閳ь剚寰勯幇顓犲幍闁哄鐗婂畷妯肩矆鐎n喗鐓冪憸婊堝礂濞戞氨鐭嗗ù锝囨櫕娴滀粙姊洪懡銈呬沪缂佸鐗撳畷婊冣攽鐎e墎绋忛悗骞垮劚閹冲寮ㄦ禒瀣厽闁归偊鍓欑痪褎銇勯妷褍浠遍柡灞剧洴瀵噣鍩€椤掑嫭鍋嬮柡鍥f噰閳ь剨绠撳畷绋课旈埀顒傜不閿濆鐓ラ柡鍐ㄦ肠閹烘绠┑鐘崇閳锋垹绱掔€n偄顕滄繝鈧导瀛樼厽闁绘梹娼欐慨鍌溾偓瑙勬礃椤ㄥ懘鎮惧┑瀣劦妞ゆ帒鍊归~鏇㈡煙閻戞﹩娈㈤柡浣割儔閺屾稑鈽夐崡鐐茬婵炲濮甸幃鍌炲箖濡ゅ啯鍠嗛柛鏇ㄥ墰椤︺劎绱撴担绛嬪殭闁绘妫濋、姘舵晲閸℃瑯娴勯柣搴到閻忔岸寮查悙鐑樷拺闁告稑锕﹂幊鈧梺绋垮閻擄繝骞嗛崼锝囩杸婵炴垶鐟㈤幏缁樼箾鏉堝墽鍒伴柟璇х節瀹曨垶鎮欓悜妯煎幈闂佸搫鍟幐楣冩偩閻㈢鍋撶憴鍕;闁告鍟块锝嗙鐎e灚鏅濋梺闈涚墕鐎氼噣鎮峰┑瀣拻濞达絽鎲¢幆鍫㈢磼鐎b晝绐旂€规洏鍨虹粋鎺斺偓锝庡亜娴滄鈹戦悙鍙夘棡闁圭ǹ鎽滈惀顏囶樄闁哄本鐩、鏇㈡偐閹绘帒袘闂備椒绱徊鍧楀磿閵堝棛鈹嶅┑鐘插绾惧ジ鏌曡箛鏇炐i柣婵囩箞濮婃椽宕崟顓犲姽缂傚倸绉崇欢姘舵偘椤斿槈鐔轰焊閺嵮傚濠电偞鍨堕悷锛勭磽濮橆厹浜滈柨鏂跨仢瀹撳棙鎱ㄦ繝鍐┿仢鐎规洦鍋婂畷鐔碱敇閻樻彃蝎缂傚倸鍊烽懗鍓佸垝椤栨粍宕查柛宀€鍋為崑鈺冣偓鐟板閸嬪﹤岣块妸鈺傜厓鐟滄粓宕滈悢濂夊殨妞ゆ劧绠戠粻娑㈡煛婢跺﹦浠㈢紒鎰☉椤啴濡堕崱妤€娼戦梺绋款儐閹稿濡甸崟顖毼ㄩ柨鏇楀亾闁告繄鍎ら幈銊︾節閸屻倗鍚嬮悗瑙勬礃鐢帡鍩㈡惔銊ョ疀妞ゆ柨鎼禒鎺楁⒑鐠囧弶鍞夋い顐㈩槸鐓ゆ繝濠傜墕閺嬩線鎮归崶顏勭毢闁哄棴闄勯妵鍕冀椤愵澀绮堕梻浣斤骏閸婃牗绌辨繝鍥ч柛灞剧煯婢规洟姊绘担鍦菇闁稿﹥顨婂畷鎴﹀箻閼搁潧搴婂┑鐐村灟閸ㄥ湱绮婚敐鍡欑闁糕剝顨堢粻鎶芥煕閺冣偓閹稿啿顫忛悜妯诲闁规鍣Σ顔碱渻閵堝棗鐏ユい锕傛涧椤曪絾绻濆顑┾晠鏌曟径鍫濈仾闁哄倵鍋撻梻鍌欒兌绾爼宕滃┑瀣櫇闁宠桨绲煎☉銏犖ч柛銉㈡櫇閿涙繃绻涙潏鍓у埌鐎殿喖鐖奸、鎾诲幢濞戞瑧鍘遍柣搴秵閸嬪懐浜搁幍顔剧<缂備焦岣跨粻鎾绘煃缂佹ɑ宕岀€规洖缍婇、娆撴偩鐏炲吋鍠氶梻鍌氬€烽悞锔锯偓绗涘厾鍝勵吋婢跺﹦鏌ч梺缁樓圭亸娆撳汲閿曞倹鐓忛煫鍥ь儏閳ь剚鐗滈埀顒傛暩婵挳鈥︾捄銊﹀磯闁绘垶锕╁Λ锟犳⒑鐠囨煡顎楅柟纰卞亰閸╃偤骞嬮敂钘変汗闁荤姴娉ч崘褏鐭楅梻浣筋嚙鐎涒晠宕欒ぐ鎺戠獥婵﹩鍓﹂崵鏇犳喐閺冨牆鏄ラ柍褜鍓氶妵鍕箳閹存繍浠鹃梺鎶芥敱閸ㄥ灝顫忔繝姘唶闁绘梻鍎ら崚娑㈡⒑缂佹ḿ鈯曠紒顔兼捣濡叉劙骞掑Δ鈧粻鐢告煙閻戞ê鐏嶉柟绋垮暙閳规垿鎮欓弶鎴犱患闂佽桨娴囬褔鎮惧畡鎵冲牚闁糕檧鏅滄瓏闂備浇顕х€涒晠宕欒ぐ鎺戠闁绘梻鍘ч拑鐔衡偓骞垮劚椤︻垱瀵奸悩缁樼厱闁哄洢鍔屾晶顔界箾閸涱偄鈧繂顫忛搹鍦<婵☆垵顕х喊宥夋⒑閸濄儱鏋戦柟绋垮暱椤曪絿鎷犲ù瀣潔濠碘槅鍨堕弨閬嶅棘閳ь剟姊绘担铏广€婇柛鎾寸箞閵嗗啳绠涢弮鍌ゆ祫婵°倧绲介崯顖炲煕閹达附鈷掗柛顐g濞呭洨绱掔€n剛甯涘ǎ鍥э躬閹瑩骞嶉鍓у幆闁诲孩顔栭崰鏍€﹂悜钘夋瀬闁归偊鍘肩欢鐐测攽閻樻彃顏撮柛鐔奉儔閺岋絾鎯旈妶搴㈢秷濠电偛寮堕悧鏇犲弲闂侀潧艌閺呪晠寮繝鍥ㄧ厱闁靛鍨甸張顒傗偓闈涚焸濮婃椽妫冨☉姘暫婵°倗濮锋灙妞ゆ洩缍佹俊鎼佹晜閸撗屽晭濠电姰鍨煎▔娑㈩敄閸℃瑧鐭嗛悗锝庡亽濞堜粙鏌i幇顓熺稇闁诲繐顕埀顒冾潐濞叉粓宕伴弽顓溾偓浣糕槈濡攱顫嶅┑鐐叉缁绘劖鎱ㄩ崘顔解拻闁稿本鐟︾粊鎵偓瑙勬礈閺佽鐣锋导鏉戝唨妞ゆ挾鍋熼敍娑欑節閻㈤潧孝婵炲眰鍊曟晥闁告瑥顦禍婊堟煙閺夎法鍩f俊缁㈠櫍閺屽秹鏌ㄧ€n亞鐟ㄩ梻鍥ь樀閺屻劌鈹戦崱妯烘闂佸摜鍠撻崑銈夊蓟濞戙垺鍋勯柛婵嗗濞岊亪姊洪柅娑氣敀闁告柨绉堕幑銏犫攽鐎n亞顦板銈嗗坊閸嬫挻绻涢崼婵堢伇闁逞屽墮閸樻粓宕戦幘缁樼叆婵犻潧妫欓崳钘壝归悩顔肩伈闁哄苯绉堕幏鐘诲蓟閵夈儱鍙婃俊銈囧Х閸嬬偛鐜婚崸妤€鐒垫い鎺戝濞懷囨煙閼恒儳鐭掔€殿喗濞婃慨鈧柕鍫濇閹峰姊虹粙鎸庢拱闁煎綊绠栭崺鈧い鎺戝€搁崢鎾煙閾忣偒娈滅€规洘绮嶉幏鍛矙鐠恒劋鍠婂┑锛勫亼閸婃牠鎮у⿰鍫濈;闁绘劕鎼悿鐐亜韫囨挾澧涢柍閿嬪笒闇夐柨婵嗙墱濞兼劙鏌曢崶鈺佹瀻闂囧绻濇繝鍌氼伀闁瑰啿娲ㄩ埀顒冾潐濞测晝鎹㈠┑鍡欐殾婵せ鍋撻柟宕囧█椤㈡鎷呯拠鈥虫櫗闂傚倸鍊烽懗鍫曘€佹繝鍥х妞ゅ繐妫涙稉宥夋煙鏉堟崘顓虹紓宥嗙墵閺屾稑鈽夊Ο鍏兼喖闂佺粯鎸搁崯鎾蓟瀹ュ棙濮滈柟娈垮櫘濡差噣姊洪崫鍕棡闁荤啙鍥х劦妞ゆ帊绶¢崯蹇涙煕閻樻剚娈橀柍褜鍓涢悷鎶藉川椤旂厧绨ユ繝鐢靛█濞佳囶敄閸℃稑纾婚柕濞炬櫆閳锋帡鏌涢銈呮瀻闁搞劋绶氶弻鏇$疀鐎n亖鍋撻弽顓熷亗闁哄洢鍨洪悡鐔兼煛閸ャ劍鐨戞い锔肩畵閺岋綀绠涢妷褏鏆犻梺瀹狀潐閸ㄥ潡寮幘缁樺亹闁惧浚鍋婇弫顏堟⒒娴e摜鏋冩い顐㈩樀瀹曞綊宕归鐐闂佺粯鎸哥€垫帒岣块埡鍌樹簻闁瑰瓨绻勬禒銏°亜閵夛箑鍝烘慨濠冩そ閹筹繝濡堕崨顔锯偓楣冩⒑閼姐倕鏋傞柛搴㈠▕閸┾偓妞ゆ帊绀侀崵顒勬煕濡寧顥夋い鏇樺劦瀹曠喖顢涘槌栨Ч婵$偑鍊栭悧妤冪矙閹捐鍌ㄩ梺顒€绉甸悡鐔煎箹閹碱厼鐏g紒澶愭涧闇夋繝濠傛噹閸樺鈧鍠撻崝搴ㄥ箯閻樼粯鍎撴い鎺嗗亾闂佸府绲介悾鐑藉箚闁附顎夐梻鍌氣看閸擄箓宕滈悢鐓庤摕闁绘梻鈷堥弫濠囨煟閿濆懐鐏遍柣鎾愁樀濮婃椽宕烽鈧ぐ鎺撴櫇闁靛/鍛触闂佺粯姊婚崢褔鎮″鈧弻娑⑩€﹂幋婵囩亪濡炪値鍋勫ú顓烆潖濞差亜浼犻柛鏇ㄥ墯閹峰崬鈹戦悙璺虹毢闁哥姴閰i幃楣冩倻閼恒儱浜楅柟鐓庣摠钃遍柡鍌楀亾闂傚倷鐒﹂幃鍫曞磿濠婂懍娌柟閿嬦缚閸犳牕顫忛搹瑙勫珰闁告瑥顦弨顓烆渻閵堝骸浜滄い锔诲灣閸欏懎鈹戦悩璇у伐闁绘妫涚划锝呂旈崨顓狀啇濠电儑缍嗛崜娆愪繆婵傚憡鐓熼柟鎹愭彧閼板潡鏌″畝鈧崰鎰缚韫囨柣鍋呴柛鎰ㄦ櫓閳ь剙绉瑰娲传閸曨剙顎涢梺鍛婃尵閸犳牕顕g拠娴嬫闁靛繒濮村畵鍡涙⒑闂堟胆褰掑磿閹殿喛濮抽柣銏犳啞閳锋垿鏌涘┑鍡楊伌婵☆垰鐗撻弻娑樷枎韫囨挻娈銈庡亜缁绘﹢骞栬ぐ鎺戞嵍妞ゆ挾濮烽崢顖炴⒒娴e憡鍟為柣妤佸灴瀹曟粌鈹戠€n亝鐎俊銈忕到閸燁垶鍩涢幋鐘电=濞达絿娅㈡笟娑欑箾閸喐绀冪紒缁樼洴瀹曪絾寰勫畝鈧悡澶愭倵鐟欏嫭绌跨紓宥勭閻g兘濡歌閸嬫挸鈽夊▍杈ㄥ哺楠炲繐煤椤忓應鎷洪梺闈╁瘜閸樻劙宕烽娑樹壕婵炴垶甯楀▍鍥╃磼椤旇偐澧﹂柛鈹惧亾濡炪倖甯掔€氼參鍩涢幋鐘电<閻庯綆浜滈惃锟犳煛閳ь剚绻濆顓犲幍濡炪倖姊婚崢褔鍩€椤掆偓濞硷繝鎮伴鈧畷鍗炩枎鎼淬垹濯伴梺鍝勵槺閸嬬偟鈧瑳鍏炬盯宕橀妸褎娈鹃梺闈浥堥弲鈺呭极婵犲洦鐓欐い鏍ф閸熶即鎮块崟顖涒拻闁稿本鑹鹃埀顒勵棑濞嗐垹顫濈捄铏瑰姦濡炪倖甯婇懗鍫曞煡婢跺备鍋撶憴鍕碍婵☆偅鐟ч幑銏犫槈濞嗘劕顎撻梺鍛婂姇瀵爼骞栭幇鐗堢厱闁瑰濮存牎缂備胶绮惄顖炵嵁鐎n亖鏋庨煫鍥ㄦ磻閻ヮ亪姊绘担铏瑰笡闁圭ǹ顭烽幆鍕敍閻愯尪鎽曞┑鐐村灟閸ㄥ綊宕¢搹顐$箚闁靛牆瀚崝宥夋煟濠靛洦顥堟慨濠冩そ瀹曘劍绻濋崘鐐棝缂傚倷鑳舵慨鐢稿箲閸パ屽殨濠电姵纰嶉弲顒勬煕閺囥劋绨奸柛鏇炲暣濮婄儤瀵煎▎鎴濆煂闂佹椿鍋呴〃濠冧繆閻戣姤鏅滈弶鐐村閻╁酣鏌i悢鍝ョ煀闁活剛鍘ч埢搴ㄥ閻欌偓濞尖晠鎮瑰ú顏嗙窗闁硅姤娲栭埞鎴︽倷閺夋垹浠ч梺鎼炲妼濠€杈╁垝缂佹ḿ绡€婵﹩鍘鹃崢鍛婄節閵忥絾纭炬い鎴濇嚇閹﹢濡烽埡鍌滃幍闂佽姤锚椤﹁鲸绂掑☉姘辩<缂備焦岣跨粻姗€鏌涢悩璇ф敾鐎垫澘瀚悾婵嬪焵椤掑嫭鏅柣鏂垮悑閳锋垿寮堕悙闈涱暭缂佷胶澧楅妵鍕即閸℃澶勯柛瀣ф櫊閺岋綁骞嬮敐鍛呮捇鏌涚€n亜顏柣銉邯楠炲繐鐣濋崟顐f嚈闂備礁鎼幏瀣礈濞嗘挸鐓橀柟杈惧瘜閺佸﹪鏌¢崒妯衡偓娑㈠焵椤掑啯纭堕柣銉邯椤㈡﹢鎮㈢粙搴撳亾閹邦喒鍋撶憴鍕闁告挻鐟ч崣鍛渻閵堝懐绠伴柟鍐差樀楠炲繒绱掑Ο鑲╊啎闁哄鐗嗘晶鐣岀矓椤掍胶绠鹃柛婊冨暟缁夘喖鈹戦垾宕囨憼缂佺粯绻堝畷鍫曞Ω瑜嶉獮鍫ユ⒒娴g瓔娼愰柛搴㈠▕椤㈡岸顢橀悩鍏哥瑝闂佺粯鍔栫粊鎾绩娴犲鐓ユ繛鎴灻顏堟煛閸♀晛澧撮柡宀€鍠栭、娆撴偩鐏炴儳娅橀梻渚€鈧偛鑻晶瀛樼箾娴e啿娲ょ粻鐑樼節婵犲倹顥撳ù婊呮嚀铻栭柨婵嗘噹閺嗙偤鏌嶉柨瀣伌闁哄本绋戦埞鎴﹀幢濡ゅ﹣鐥柣搴f嚀閹诧紕鎹㈤崼銉ヨ摕婵炴垯鍨洪崑鎰版煣韫囷絽浜滈柡鍡橆殜閹鈻撻崹顔芥闂佹悶鍎滈崨顓炐曞┑锛勫亼閸婃牜鏁幒鏂哄亾濮樼厧寮柛鈺傜洴楠炲鎮欓弶鎴濅紟闂備浇宕甸崰鎾存櫠濡ゅ懎绠归柟鎵閻撶喖鐓崶銊﹀碍缂佺嫏鍛<缂備焦岣块埊鏇㈡煙瀹勭増鍤囩€规洘锕㈠畷锝嗗緞濡椿妫撻梻鍌欑閹诧繝鎮烽敃鍌氱闁告劕妯婂ḿ鏍р攽閻樺疇澹樼痪鎯у悑缁绘盯宕卞Ο铏圭懆闂佸憡锕换婵嬪蓟閿涘嫧鍋撻敐鍛倎缂併劌銈搁弻鏇㈠炊瑜嶉顓燁殽閻愬樊鍎忛柍瑙勫灴瀹曞爼鎳滅喊澶岀婵犲痉鏉库偓妤佹叏閻戣棄纾婚柣鎰惈閸ㄥ倿鏌涢…鎴濇灓闁哄棴绠撻弻娑㈩敃閿濆棗顦╅梺杞扮濡繈寮诲鍫闂佸憡鎸鹃崰鏍嵁韫囨稑绠i柨鏃囨娴滄粓姊洪崨濠勭細闁稿孩濞婇、娆撳即閵忊檧鎷洪梺鑽ゅ枛閸嬪﹪宕甸悢鍏肩厱閹兼番鍨规慨宥夋煙椤旀儳浠辨鐐寸墬閹峰懘宕烽鐐茬闂傚倷绀侀幉锟犲礉閹达箑绀夐幖娣灪濞呯娀鏌¢崶鈺佇ョ痪鎯с偢閺屽秷顧侀柛鎾跺枎閻e嘲顫滈埀顒勩€佸▎鎾村仼閻忕偠妫勬俊鍥ㄧ節閻㈤潧啸闁轰焦鎮傚畷鎴濃槈閵忊€斥偓鑸电節闂堟侗鍎忛柣鎺戠仛閵囧嫰骞掑鍫濆帯婵犫拃鍛毈闁哄瞼鍠栭、娑橆潩閸楃偐鍙㈢紓鍌欒兌婵數绮欓幋锕€鐓″璺号堥弸搴ㄦ倶閻愭潙鍔ゆい蹇曞劋缁绘繈鎮介棃娑楀摋闂佽妞挎禍鐐差嚗婵犲啰顩烽悗锝庝簽閻ゅ懘姊虹捄銊ユ灁濠殿喖顕划璇差潩閼哥數鍘卞銈嗗姂閸婃洟寮搁崒姣懓饪伴崟顓犵厜闂佸搫鐬奸崰鎾诲焵椤掍胶鈯曞畝锝堟硶缁寮介鐔哄幈闂佹寧绻傚ú锕€鈻嶉弴鐘电<閺夊牄鍔屽ù顔姐亜閵忥紕鎳囬柟宕囧仱婵$兘顢欑憴锝嗗瘶闂傚倸鍊风欢姘缚瑜嶇叅闁挎洖鍊哥粈澶嬬箾閸℃ɑ灏电€规挷绶氶弻鐔兼倻濮楀棙鐣剁紓浣哄缂嶄線寮婚妸銉㈡斀闁糕剝锕╁Λ锟犳⒑閸濄儱鏋戞俊鐐舵椤繑绻濆顒傦紲濠电偛妫欓崺鍫澪i鈧娲捶椤撴稒瀚涢梺绋款儏鐎氭澘锕㈡笟鈧娲川婵犲啫顦╅梺鍛娒肩划娆撴晲閻愬搫鍗抽柕蹇ョ磿閸樻悂姊洪幖鐐插姌闁稿酣浜堕幃姗€顢旈崼鐔哄幈闁诲函绲介崥鈧梺顓у灦閺岋紕浠﹂悾灞濄儲銇勮缁舵岸寮诲☉銏犵閻犺櫣鍎ら悘鍫ユ倵濞堝灝鏋涙い顓犲厴瀵偊骞囬弶鍨€垮┑鈽嗗灠閹碱偅淇婇搹顐$箚闁绘劦浜滈埀顒佺墵閹兾旈崘銊ョ亰闁瑰吋鐣崹缁樻櫠閳ユ枼鏀介柣妯虹仛閺嗏晠鏌涚€n偆娲撮柟顔芥そ婵℃瓕顦查柛銊︾箞楠炴牕菐椤掆偓婵¤偐鐥幆褜鐓奸柡宀嬬秮楠炲洭顢欓懞銉︾槑闂備焦妞块崢濂杆囬悽绋胯摕闁绘柨鍚嬮崐缁樻叏濡も偓濡瑩鎮鹃崜浣虹=濞达絽鎼牎濠殿喗菧閸旀垿鐛径宀€鐭欓幖瀛樻尭閻楁岸姊洪崨濠傚Ё闁奸潧缍婂畷鎴﹀箻鐠囪尙顔婇梺瑙勫劤婢у酣鎯侀崼婵冩斀妞ゆ梹鏋绘笟娑㈡煕濮椻偓缁犳牕鐣烽姀銈庢晜闁割偆鍟块幏娲⒑閸涘﹥灏扮憸鏉垮暞缁傚秴鈹戦崼銏紲闁荤姴娲╃亸娆愭櫠閿斿浜滈柕蹇婂墲鐏忣參鎽堕弽顓熺厓鐟滄粓宕滈悢鍑よ€垮ù锝囩《閺€浠嬫煟濡鍤嬬€规悶鍎甸幃妤€顫濋悡搴㈢亾缂備緡鍠栭…宄邦嚕娴犲鏁冮柕鍫濇祫缁辫尙绱撻崒姘偓鐑芥倿閿曗偓閻滃宕归姘虫閳ь剛鏁哥涵鍫曞磻閹捐埖鍠嗛柛鏇ㄥ墰閳规稓绱撴担绋跨骇闁稿孩濞婇、姘跺Ψ閳轰胶顦板銈嗙墬閼瑰墽绮e☉姗嗘富闁靛牆妫涙晶顒傜磼椤斿ジ鍙勯柟顔诲嵆婵$兘鍩¢崒妤佸闂備胶枪閺堫剟鎮烽妸鈺佺鐎光偓閸曨剛鍘甸梺鎯ф禋閸嬪懐浜搁悽鐢电<妞ゆ梹顑欓崵娆愩亜閹惧啿鎮戠€垫澘瀚换婵嬪磼濠ф儳浜炬い鎾卞灪閸嬧剝绻濇繝鍌涘櫣妞わ絽銈搁幃浠嬵敍濞戞ɑ璇為梺璇″枓閳ь剚鍓氬ḿ銊╂煃瑜滈崜鐔奉嚕婵犳碍鍋勯悶娑掆偓鍏呭闂佹眹鍨诲▍銉ф兜閸涱亜褰洪梻鍌氬€烽懗鑸电仚濡炪倖鍨靛Λ婵嬬嵁閹达箑鐐婃い鎺嗗亾闁哄绶氶弻鐔兼焽閿曗偓楠炴鏌涙惔锝呮灈闁哄苯绉规俊鐑藉Ω閵夈劍鏆遍梻浣虹《閺呮盯骞婅箛鏇熷床婵犻潧鐗嗛弸鍫熶繆椤栨稒銇熸繛鍏煎灴濮婅櫣绮欏▎鎯у壈闁诲孩纰嶅姗€鎮鹃悜绛嬫晬闁绘垵妫欓弲婵嬫⒑閹稿孩纾甸柛瀣崌閺岋綁骞樻潏鎹愨偓鍧楁煛瀹€鈧崰鎰缚韫囨柣鍋呴柛鎰ㄦ櫓閳ь剙绉瑰铏圭矙閸栤€冲闂佺ǹ绻戦敃銏狀嚕婵犳艾鐒洪柛鎰╁妿缁愮偤鏌f惔顖滅У濞存粎鍋炵粋鎺楀礂閼测晝顔曢柣搴f暩鏋弽锟犳⒑鐠団€虫灈闁稿﹥鎮傞敐鐐剁疀閹句焦妞介、鏃堝川椤撴繄鏆楅梻浣侯攰婢瑰牓骞撻鍡楃筏闁圭ǹ瀵掑▓顓犵磽閸屾艾鈧悂宕愰悜鑺ュ殑闁肩ǹ鐏氶崣蹇涙煟閵忕姵鍟為柛瀣儔閺岋綁骞囬鐓庡闂佺ǹ瀛╅〃鍛扮亙闂佹寧绻傞幊搴ㄥ汲閻愮儤鐓冮梺鍨儏閻忓瓨鎱ㄦ繝鍐┿仢妞ゃ垺娲熸俊鍫曞川椤掑倹宕熼梻鍌欑閸氬顪冮崸妤€鍨傞梺顒€绉撮悿楣冩煕閹捐尪顔夐柛瀣尭閳藉鈻嶉搹顐㈢伌鐎规洩缍€缁犳盯骞橀娑欐澑闂備胶绮敋鐎殿喖鐖煎畷鎶芥倻濡晲绨婚棅顐㈡处濞叉牠鍩㈤崼銉︾厸鐎光偓閳ь剟宕伴幇鍏洭鎮ч崼鐔峰妳闂佹娊鏁崑鎾绘煛鐎n亝鍣归摶鏍煟濮椻偓濞佳勭閿曞倹鐓欓柣鐔哄閸犳﹢鏌e☉鍗炴珝妤犵偞甯¢獮瀣籍閳ь剟寮埀顒勬⒒娴h櫣銆婇柛鎾寸箞婵$敻宕掗悙鍙傗晝鎲歌箛鏇烆棜濞寸姴顑嗛悡鏇㈡倶閻愭彃鈷旈柟鍐叉閺屾稖绠涢幘鍓佸姱闂佸搫鏈粙鎾诲焵椤掑﹦绉甸柛瀣噽娴滄悂顢橀悢缈犵盎濡炪倖鎸鹃崑鐔哥閵忋倖鎳氶柨婵嗩槹閻撶姵绻涢弶鎴剱婵炲懎娲弻锝夊箻閹颁礁鍓跺┑顔硷攻濡炶棄鐣烽悜绛嬫晣闁斥晛鍠氶埀顒侇殜濮婃椽妫冮埡鍐i梺鎼炲妼绾绢厼危閹扮増鍊烽柛婵嗗閸炪劑姊洪棃娴ゆ盯宕ㄩ娑辨綋闂傚倸鍊搁崐鎼佸磹閹间焦鍋嬪┑鐘插暟閻熻淇婇妶鍛櫣缁炬儳娼¢悡顐﹀炊閵娧€妲堢紓浣哄У瀹€鎼佸蓟閿濆妫橀柛顭戝枟閸婎垶姊洪幎鑺ユ暠闁搞劌娼¢獮鍐ㄎ旈崨顓熷祶濡炪倖鎸鹃崐顐︽晲婢跺鍘梺绯曞墲椤ㄥ懘寮抽敐澶嬬厸閻忕偠顕ч埀顒佺箓閻e嘲顫滈埀顒勫箠閻樻椿鏁嗛柍褜鍓熼幃锟犳偄閸忕厧鈧敻鎮峰▎蹇擃仾缂佲偓閸愵亞纾奸悹鍥皺婢э妇鈧鍣崑濠傜暦濮椻偓椤㈡瑩鎳栭埡浣感曞┑锛勫亼閸婃牜鏁幒鏂哄亾濮樷偓閸パ呭姦濡炪倖甯婇悞锕偹夐崼鈶╁亾鐟欏嫭绀冮柨鏇樺灲閵嗕礁鈻庨幘鍐茬哎婵犮垼顕栭崹鏉棵洪敃鍌涘亗闁哄洢鍨洪悡鍐煃鏉炴壆顦﹂柡瀣ㄥ€栫换娑㈠醇閻曞倽鈧潡鏌″畝瀣М闁诡喓鍨藉鍫曞箣濠垫劖缍嗗┑鐘愁問閸犳牠鏁冮妸銉㈡瀺闁挎繂娲ら崹婵囩箾閸℃ɑ灏紒鈧畝鍕厓闁靛鍎辩敮鐘电磼閹插鎮肩紒杈ㄦ崌瀹曟帒顫濋钘変壕闁告縿鍎抽惌鎾绘煙缂併垹鏋熼柡鍛箞閺屾洟宕煎┑鎰ч梺绋款儌閺呯娀寮婚敐澶婄闁挎繂鎲涢幘缁樼厱閻庯絻鍔屾俊璺ㄧ磼鏉堛劌绗ч柍褜鍓ㄧ紞鍡涘储閻e本鍏滈柛顐f礃閻撴洟鏌¢崘鈺傚暗闁伙綀椴搁妵鍕敂閸曨偅娈绘繝纰樷偓宕囧煟鐎规洖宕灃闁告劦浜濋崳顖炴⒒娴g瓔鍤欓悗娑掓櫊瀹曟瑨銇愰幒鎴犵厬闂佸憡鍔﹂崰鏍不閺嶎厽鐓ラ柣鏂挎惈鏍¢梺绋款儏鐎氫即寮婚敐澶婄闁惧浚鍋呭畷鍐差渻閵堝棙鈷愰柛鏃€娲熼崺鐐哄箣閿旇棄鈧鏌涢妷銏℃珖閺嶏繝姊绘担鍛婂暈闁圭ǹ顭烽幃鐑藉煛閸涱厾鐣哄┑顔姐仜閸嬫捇鏌涢埡瀣瘈鐎规洏鍔戦、娆撳箚瑜嶇粻鐐烘⒒閸屾瑧绐旀繛浣冲洦鍋嬮柛鈩冿供濞堜粙鏌涘☉姗堟敾婵炲懐濞€閺岀喓绱掗姀鐘崇亶闂佺粯鎸婚惄顖炲箖濮椻偓閹瑩骞撻幒鍡樺瘱闂備礁鐤囧Λ鍕囬悽绋跨闁割偅娲橀弲鎻掝熆鐠轰警鍎戦柛姗€娼ч—鍐Χ閸℃ê鏆楅梺鍝ュТ濞撮鍒掗銏犵闁圭偨鍔岀紞濠囧箖椤忓牆鐒垫い鎺戝闂傤垶鏌ㄥ┑鍡樺婵炲吋鐗楃换娑橆啅椤旇崵鍑归梺绋匡功閸忔﹢寮婚敃鈧灒濞撴凹鍨辩瑧濠电姵顔栭崳锝壦夐幘鑸殿潟闁规儳鐡ㄦ刊鎾煕濠靛棗鐝旈柨婵嗩槹閻撴瑩鏌涘☉姗堟敾闁稿﹥鍔欓弻鐔碱敋閳ь剛绮婚弽顓炵畺闁秆勵殢閺佸秵淇婇婵愭綈闁活偄绻樺缁樻媴閸涘﹨纭€闂佺ǹ绨洪崐妤呭箲閵忋倕绀冩い鏃囧亹閺屟囨⒑閸愬弶鎯堥柟鍐茬箻閸╂盯骞嬮敂瑙f嫽闂佸壊鍋嗛崰搴ㄥ窗閺囩姷纾奸柟鎻掝儑缁♀偓闂佸搫鏈惄顖炵嵁閸ヮ剙惟闁挎梻鏅ぐ鍥р攽閻愯尙鎽犵紒顔惧У缁傚秹顢旈崟鍨稁缂傚倷鐒﹁摫濠殿垰顕槐鎺戔槈濮楀棗鍓板┑鐐茬墛閸旀瑥顫忓ú顏勪紶闁靛鍎涢敐澶嬪仺妞ゆ牗銇涢崑鎾崇暦閸ャ劍顔曟繝鐢靛Т閿曘倝宕悩璇茬哗濞寸姴顑嗛崐鐢告煥濠靛棛鍑圭紒銊ょ矙閺岋綁鏁愭径宀€鏆┑顔硷攻濡炶棄鐣烽锕€绀嬫い鎰剁稻椤斿嫰姊绘担铏瑰笡妞ゃ劌鎳橀弫鍐敂閸曢潧娈ㄩ梺鍝勮閸庨亶鎷戦悢鍏肩厪濠㈣埖绋戦々顒勬煕濮椻偓娴滆泛顫忓ú顏咁棃婵炴垼椴歌倴闂備焦鎮堕崝宀勫箹椤愶箑鐓濈€广儱顦獮銏$箾閹寸偟鎳呴柛妯兼暬閺岋綁鎮╅崣澶婂范闂佸憡渚楅崵鏌ュ箣閻樼數锛濇繛杈剧秬濞咃絿鏁☉姘辩<閻犲洩灏欐晶锔筋殽閻愭彃鏆炵紒鍌涘笧閳ь剨缍嗛崑鎺懳涢崘銊㈡斀闁绘劖顔栧Λ搴g磽閸粌宓嗙€规洘娲熼幃鐣岀矙閼愁垱鎲伴梻浣规灱閺呮盯宕娑樺灁闁圭虎鍠楅崑鈩冪箾閸℃绠版い蹇婃櫊閺屽秷顧侀柛鎾村哺瀹曟繂螖閸涱厾鍔﹀銈嗗笒閸犳艾岣块幇顓犵闁告瑥顧€閼拌法鈧娲栫紞濠囧箖閻e瞼鐭欓悹鎭掑妼瀵劌鈹戦悩顔肩伇婵炲绋栭惂宀勬⒑缂佹ɑ鐓ラ柣銊︾箞瀹曞ジ顢旈崼鐔哄幈濠电偞鍨靛畷顒勭嵁濡ゅ懏鐓熼幖绮光偓鏂ユ寖缂備浇椴搁幐濠氬箯閸涘瓨鎯為柣鐔稿椤愯偐绱撻崒娆愮グ妞ゆ泦鍥ㄥ亱闁糕剝绋掗崑鈺冣偓鐟板閸嬪﹤岣块妸鈺傜厓鐟滄粓宕滈悢鐓幬ュ〒姘e亾鐎殿噮鍓欓埢搴ㄥ箚瑜庨崐顖炴⒒娴h櫣銆婇柛鎾寸箘缁瑩骞掑Δ鈧Ч鏌ユ煕濞戝崬鏋ょ紒鈾€鍋撻梻浣圭湽閸ㄨ棄岣胯閺嗏晠姊绘担鑺ャ€冪紒鈧笟鈧獮澶愭晬閸曨剙搴婂┑鐐村灟閸ㄥ綊鎮為崹顐犱簻闁瑰搫绉烽崗宀€绱掗悩鍐插姢闂囧鏌ㄥ┑鍡樺櫣闁哄棜椴哥换娑㈠级閹存績鍋撻崹顕呭殨妞ゆ劧绠戠粈瀣亜閺嶃劎銆掗柛妯哄船閳规垿鎮欓弶鎴犱桓鐎光偓閿濆懏鍋ユ鐐搭殜閹晝绱掑Ο鐓庡箞闂佽鍑界紞鍡樼濠婂牆鐒垫い鎺嗗亾婵炲皷鈧剚鍤曞┑鐘崇閺呮悂鏌eΟ鍨毢闁稿﹦鍋ゅ娲濞戣鲸肖闂佺ǹ姘﹀▍鏇犵矉閹烘挶鍋呴柛鎰ㄦ杹閹疯櫣绱撻崒娆戝妽閽冮亶鎮樿箛搴″祮闁哄矉缍侀幃銏ゅ矗婢跺褰嬫俊銈囧Х閸嬫盯宕銉т簷闂備礁鎲℃笟妤呭窗閺嶃劎顩锋繛宸簼閳锋垿鎮圭€n亪顎楅悗姘煎弮閿濈偛螖娴e吀绨诲銈嗗姂閸╁嫬危閾忓湱纾兼い鏃傗拡閸庡繑銇勯幘鍐叉倯鐎垫澘瀚埀顒婄秵娴滄瑧鑺遍崹顐$箚闁靛牆娲ゅ暩闂佺ǹ顑囬崰鏍х暦娴兼潙绠婚悹鍥皺閻ゅ洭姊洪崷顓炰壕闁活亜缍婂畷鎴﹀箣濠㈡繂缍婂畷妤呭礂閼测晝鈻忕紓鍌欒閸嬫捇鎮楅敐搴′簴濞存粍绮撻弻鐔煎箲閹邦厾銆愰柛鐔告倐濮婃椽宕ㄦ繛姘灩閸掓帡骞橀幇浣圭稁缂傚倷鐒﹁摫濠殿垱鎸抽弻娑樷槈濮楀牊鏁鹃梺绋垮閹瑰洤顫忛崫鍔借櫣鎷犻幓鎺濇交闂備線娼ч悧蹇旂仚闂佷紮缍侀弨杈┾偓闈涖偢瀵爼骞嬪┑鍡樻殢闂佽崵鍠愮划宥囧垝閹惧磭鏆﹂柣銏⑶归崡鎶芥煏韫囥儳纾块柛妯哄船椤啴濡堕崱妤€衼缂備焦褰冩晶鐣屽垝閸儱鐒垫い鎺戝閳锋垿鏌熼懖鈺佷粶濠碘€炽偢閺屾稒绻濋崒婊呅ㄦ繝纰夌磿閺佽鐣烽悢纰辨晬婵﹩鍓欑粊顕€姊绘担铏瑰笡闁告梹鐗曞玻鍨枎韫囧﹥鐎洪梺闈涚墕閹冲寮ㄦ禒瀣厽闁归偊鍨伴惃鍝勵熆瑜濈徊鍓ф崲濞戙垹妞介柛鎰典簼閸嬔冣攽閳ュ啿绾ч柛鏃€鐟╅悰顔嘉熺亸鏍т壕婵炴垶顏鍫晛闁瑰墽绮埛鎴︽煕濞戞﹫鍔熺紒鐘虫崌閹顫濋梻瀵稿嚬缂備焦姊婚崰鏍ь嚕閹绢喖顫呴柍銉︽灱閸嬫捇鎮介崨濠備画濠电偛妫楃换鎰邦敂椤忓棛纾奸柍褜鍓熷畷姗€顢欓悾灞藉汲婵犳鍠楁灙闁糕晜鐗犻幃锟犲礃椤忓棛锛濇繛杈剧秬閸嬪倿骞嬩綅婢舵劕閱囬柍鍨涙櫅娴滅偓绻涢崼婵堜虎闁哄鍠栭弻鐔煎川婵犲倵鏋欏Δ鐘靛仜閸熸挳宕洪敓鐘插窛妞ゆ挾濮烽弶绋库攽閻愯埖褰х紒鑼舵閿曘垺娼忛埡鍐厯闂佽澹嗘晶妤呭煕閹烘鐓曢悘鐐插⒔閹冲懏銇勯敂濂告缂佺粯绻堥崺鈧い鎺戝閻掕偐鈧箍鍎遍幊鎰版晬閻斿吋鈷戦梻鍫熺〒婢ф洘銇勯敂璇插籍闁糕斁鍋撳銈嗗坊閸嬫捇鏌涢悢鍛婄稇闁伙絿鍏樻俊鎼佸煛婵犲啯娅栨繝鐢靛Т鑹岄柛瀣尵缁辨帒螖閳ь剟藝椤栫偛鐓橀柟杈鹃檮閸婄兘鏌℃径瀣仼濞寸姵鎮傚娲嚒閵堝懏鐝㈢紓浣瑰絻婢х晫鍒掔€n亶鍚嬮柛娑变簻閻楁岸姊洪崜鎻掍簽闁哥姵鎹囧畷銏ゆ偨閸涘ň鎷虹紒缁㈠幖閹峰岣块幇鐗堢厱闁哄啠鍋撻柣妤佺矊閳藉鎮介崨濠傗偓閿嬨亜閹烘垵鈧顢欓弴銏♀拺闁告稑锕g欢閬嶆煕濡搫鈷旂紒顔碱煼楠炴捇骞戝☉姗€鍙勭€规洘鍎奸¨鍌炴椤掑澧柕鍥у婵偓闁斥晛鍟伴ˇ鐗堢節濞堝灝鏋撻柛瀣崌濮婅櫣绱掑Ο鎾舵嚀閳诲秹寮撮姀鈺傛櫓闂佸湱鍎ら幐鍓у姬閳ь剙鈹戦悙鑼闁诲繑绻堝绋库槈閵忥紕鍙嗛梺鍝勬处閿氶柛鏃€纰嶉妵鍕敂閸曨偅娈婚梺鍦归敃銉ヮ嚗閸曨厺娌柣鎰靛墻閸熷骸鈹戦敍鍕杭闁稿﹥鐗犲畷婵婎槾缂侇喖顭烽獮瀣偐閻㈢數鍔堕梺璇插嚱缂嶅棝宕戞担鍦洸婵犲﹤鐗婇悡娆撴煕濠靛棗顏懖鏍⒑閸涘﹥鐓ョ紒澶婄秺楠炲啫螖閳ь剟锝炲┑瀣垫晢闁稿矉濡囩粈濠勭磽閸屾瑦绁板瀛樻倐楠炴垿宕惰閺嗭箓鏌熼悜妯虹亶闁哄閰i弻鐔煎箹椤撶偛绠洪悶姘剧畱閳规垿鏁嶉崟顐℃澀闂佺ǹ锕ラ悧鐘茬暦瑜版帗顥堟繛纾嬫珪缁嬫垿鍩為幋鐘亾閿濆骸澧紒渚婄畵濮婅櫣娑甸崨顔兼锭缂備胶濮甸崹鍧楀箖濞嗘劗绡€闁告劧缂氱花濠氭⒑閻熺増鎯堟俊顐n殕缁傚秵銈i崘鈹炬嫼闂佸憡绻傜€氼剟顢旈妷鈺傜厱閹艰揪绲鹃弳顒傗偓娈垮枦椤曆囶敇婵傜ǹ閱囨い鎰剁秵閳ь剙娲缁樻媴閸涘﹤鏆堥梺瑙勭摃椤曆囨偩濠靛宸濆┑鐘辫兌缁犳岸姊哄Ч鍥х伄閺嬵亞绱掗埀顒傗偓锝庡亖娴滄粓鏌″鍐ㄥ闁汇劍鍨堕妵鍕棘閸柭ゅ惈濠殿喖锕ㄥ▍锝夊箟閹绢喖绀嬫い鎺嗗亾闁告挸缍婂娲箹閻愭彃顬嬫繝鈷€鍕垫疁妤犵偛鐗撴俊鎼佸Ψ閵忊槅娼旀繝娈垮枟鏋ù婊庡墴閺佸秴鈹戦崶鈺冾啎闁哄鐗嗘晶浠嬪礆閺夋鐔嗛柣鐔峰簻瀹搞儵宕℃潏銊х鐎瑰壊鍠曠花濂告煟閹惧鈽夐棁澶愭煥濠靛棙鍣规い銉ョ箻閺岋綁骞橀悷棰佹睏闂侀€炲苯澧い鏃€鐗犲畷鏉库槈閵忊晜鏅悷婊勬瀹曟椽濡烽敃鈧欢鐐测攽閻樻彃顒㈤柛宥囨暬濮婃椽骞愭惔锝囩暤闂佺懓鍟跨粔鐢电博閻旂厧鍗抽柕蹇婃閹锋椽姊洪崷顓€鐟懊规搴d笉闁规儳澧庣壕濂告煏婵炲灝濡煎ù婊冪秺閺屻倕煤椤忓啯鍠氶悗瑙勬礃椤ㄥ牏鍒掗鐔稿闁规鍠氬▔鍧楁⒒閸屾瑧绐旀繛浣冲洦鏅煫鍥ㄧ☉缁€鍐喐鎼搭煉缍栭柡鍥ュ灪閳锋帒霉閿濆懏鍟為柟顖氱墦閺岋綁顢橀悜鍡樞ㄩ梺鐟扮畭閸ㄥ綊鍩為幋锕€骞㈡繛鍡樺姈椤旀洟姊绘笟鈧ḿ褑澧濋梺鍝勬噳閺呯姴顕i锕€鐐婃い鎺嶈兌閸樿棄鈹戦埥鍡楃仩闁诲繑绻堥幆鍐洪鍛幈濠碘槅鍨伴悘婵婎暱濠电儑绲藉ú銈夋晝椤忓牆绠栨繛鍡樻惄閺佸倿鏌涢弴妯哄濞存粓绠栭弻鐔告綇閸撗呮殸闂佹悶鍔岄崐鍦崲濞戞﹩鍟呮い鏃囧吹閺嗘姊洪柅鐐茶嫰婢ь噣鏌涢悤浣哥仯闁瑰箍鍨归埞鎴犫偓锝庝簽閿涙粌鈹戦悩璇у伐閻庢凹鍙冮、娆撳即閵忊檧鎷绘繛杈剧到閹诧紕鎷归敓鐘崇厱閹煎瓨绋戦埀顒佺箓閻g柉銇愰幒鎾充簻闂佺粯鎸搁柊锝夊船鐠轰警娓婚柕鍫濇噽缁犱即鏌eΔ鈧敃顏堝箖閿熺姴鍗抽柣鏃囨閻﹀牊绻濋悽闈浶㈤柛濠冩倐瀵啿鈻庨幘瀵稿幐闂佺硶鍓濋悷銉╁几濞戞瑯娈介柣鎰嚟婢х數鈧鍠栭悥濂哥嵁鐎n噮鏁嶆繝闈涙閸庢挸鈹戦悩鎰佸晱闁哥姵鐗犻弫鍐Χ婢跺棌鍋撻敃鈧悾锟犲箥椤旇姤顔曢梻浣告贡閸庛倝宕归悢鐓庡嚑閹兼番鍔嶉悡娆撴煟閹寸伝顏堟倶閵夆晜鍋ㄦい鏍电到閻忥附鎱ㄦ繝鍐┿仢鐎规洦鍋婂畷鐔兼濞戞ê顥濇繝鐢靛仜閻°劎鍒掗悩宕囶洸妞ゅ繐瀚烽崵鏇炩攽閻樺磭顣查柡鍛倐閺岋絽螣閼姐倕寮ㄩ梺鍝ュ仩濞夋盯鈥旈崘顔嘉ч柛鈩冾殔椤洭姊洪幖鐐插缂傚秴锕弫鎰版倷娓氼垱鏅濋梺闈涚墕濞层劑鏁嶅┑鍥╃闁瑰墽顥愭竟妯荤箾鐏炲倸鈧繂顕i幖浣瑰亜闁稿繗鍋愰崢浠嬫⒑缂佹ɑ鐓ョ€殿喛娉涢埢宥嗙節閸ャ劎鍘藉┑鐐村灥瀹曨剟寮搁妶澶嬬厓鐟滄粓宕滈妸褏绀婇柛鈩冡缚椤╂煡鏌涢锝嗙闁稿瀚伴弻娑㈠焺閸愶紕绱扮紓浣叉閸嬫捇姊婚崒姘偓鎼佹偋婵犲嫮鐭欓柟鐑橆檪婢舵劖鍋愰柣銏㈡暩閿涙粍绻濋姀锝嗙【闁兼椿鍨跺畷婵堚偓锝庡枟閻撳繘鏌涢妷鎴濆枤娴煎啯绻濆▓鍨灀闁稿鎹囧娲箰鎼达絺妲堥柣搴㈠嚬閸欏啫鐣烽幎绛嬫晩闁告挆鍜冪闯濠电偞鎸婚懝鎯洪妶澶婂嚑闁靛牆顦伴悡娑樏归敐鍫綈闁稿﹥鍔欓弻娑㈠煘閹傚濠碉紕鍋戦崐鏍暜閹烘鏅濋柨鏂垮⒔閻捇鏌i姀鐘冲暈闁绘挻娲熼幃妤呮晲鎼粹€茬盎濠电偞鎯岄崰姘跺焵椤掑喚娼愭繛璇х畵瀹曡瀵奸幖顓熸櫍闂佺ǹ绻掗崢褏娆㈤悙鐑樺€甸柨娑樺船鐎氼剟顢旈悜妯肩瘈闁汇垽娼ф禒鈺呮煙濞茶绨界紒杈╁仱閸┾偓妞ゆ帊鑳剁粻楣冩煕濠婂啫鏆熼柟顔笺偢閺屸剝绗熼崶褎鐏堥梺瀹犳椤﹀灚鎱ㄩ埀顒勬煥濞戞ê顏╂鐐茬墦濮婄粯鎷呴崨濠冨創闂佸摜鍠撴繛鈧€规洘鍨块獮妯尖偓闈涙憸椤旀洟姊洪崨濠勬噧妞わ箒椴搁弲鍫曞垂椤愮姳绨婚梺闈涚箚閳ь剙鍟块幗鐢告⒑鏉炴壆鍔嶉柛鏃€鐗曢銉╁礋椤掑倻鐦堥梺鎼炲劀閸曨剚鐦戦梻鍌氬€搁崐椋庣矆娓氣偓楠炴牠顢曢埛姘そ閹晝鎷犻懠顒婄幢闂備礁婀遍崑鎾诲礈濮樿埖鍋勯柛鈩冪⊕閻撶娀鏌熼梻瀵稿妽婵炴嚪鍐f斀妞ゆ柨鍚嬫径鍕煏閸パ冾伃妞ゃ垺娲熸慨鈧柍銉ㄦ珪閻e姊绘担鍛婃儓闁兼椿鍨崇划鏃堟偡閹殿喗娈鹃梺鑽ゅ枑婢瑰危閸喓绠鹃柛鈩兠慨澶屾喐閺夋寧鍣归柍瑙勫灴閹瑩鎳犻浣瑰枛缂傚倷绶¢崰鏍煀閿濆懐鏆﹂柟杈剧畱缁犲鏌ら幖浣规锭閹兼潙锕ら埞鎴︽倷閺夋垹浠ч梺鎼炲妼缂嶅﹪寮荤€n喖鐐婇柕濞у懐妲囬梻鍌氬€搁悧濠勭矙閹惧瓨娅犻柡鍐ㄧ墛閻擄綁鐓崶銊﹀磳闁告瑥瀚幈銊︾節閸愨斂浠㈤悗瑙勬处閸嬪﹤鐣烽悢鍏碱棃婵炴垶锚椤ュ酣姊婚崒娆掑厡闁稿海鏁诲鏌ュ煛閸涱厼鐎柣鐘烘〃鐠€锕傚吹閺囩偐鏀介柣妯虹-椤f煡鏌¢崨顔肩祷妞ゎ叀娉曢幑鍕偖閺夋垳绱i梻浣告憸閸嬫垿宕濋幋锕€绠栫€瑰嫭澹嬮崼顏堟煕閹邦厼鍔ら柛鎾崇埣閹鎲撮崟顒傤槰闂佹悶鍔嶇€笛囧箞閵娾晛鐒垫い鎺戝閻撳繘鏌涢锝囩畺妞ゃ儳濞€閺屾稑螣閹稿寒妫勯梺瀹狀潐閸ㄥ潡骞冨▎鎾崇骇闁瑰濮冲ǎ顕€鏌f惔銈庢綈婵炶绠撳畷婊冣枎閹惧磭鍘洪悗骞垮劚閹峰宕ョ€n喗鐓曢柍閿亾闁哄懏绮撻、娆撳籍閸啿鎷虹紓鍌欑劍閿氬┑顔兼川閳ь剚顔栭崰鏍偉閻撳海鏆﹂柡澶庮嚦閻旀哺褔宕堕敂鍓ф晨闂傚倷绶氬ḿ褏鎹㈤崱妞綁宕熼娑樻畬闂佺鍕垫畷闁绘挻鐟﹂妵鍕棘閹稿孩鍎撻梺璇茬箚閺呯娀寮婚敐澶嬫櫜闊洦娲滈惁鍫ユ倵濞堝灝鏋涘褍閰i獮蹇涙偐瀹曞洠鏀抽梺鍛婎殘閸嬫劙宕戦幘璇插嵆闁靛繒濮烽崢鎾⒑绾懏褰ч梻鍕瀵煡顢楅崟顒傚幈闂佸搫娲㈤崝灞剧濡ゅ懏鐓涘鑸得顔芥叏婵犲懏顏犵紒顔界懇瀹曠娀鍩勯崘鈺傛瘞闂傚倷鑳剁划顖炪€冮崼鐔稿弿闁圭虎鍣弫瀣煥濠靛棙顥犵紒鈾€鍋撴繝娈垮枟閿曗晠宕曢悽绋跨厸闁告侗鍠氶崢鎾绘煛婢跺苯浠у褎顨堢划濠囧箥椤旇棄浠忓┑鐘绘涧椤戝棝鍩涢幋锔藉仯闁搞儯鍔岀徊濠氭煕閵堝牅鍚紒杈ㄦ尭椤撳ジ宕ㄩ鍛紒缂傚倷绀侀崐鍝ョ矓閻熼偊鍤曞ù鐘差儛閺佸洭鏌i幇顓炵祷婵炲牄鍊濋弻锝嗘償閿涘嫮鏆涢梺绋块叄娴滄儼妫熸繛瀵稿帶閻°劑宕戦崒鐐寸厪濠㈣泛妫欏▍鍡涙煟閹捐泛鏋涢柡宀嬬節瀹曞爼鍩℃担椋庢崟闂備線鈧偛鑻晶顔界節閳ь剟鏌嗗鍛姦濡炪倖甯婇懗鍫曞疮閺屻儲鐓欓柛鎴欏€栫€氾拷 4509422@qq.com 濠电姷鏁告慨鐑藉极閸涘﹥鍙忛柣鎴f閺嬩線鏌涘☉姗堟敾闁告瑥绻橀弻锝夊箣閿濆棭妫勯梺鍝勵儎缁舵岸寮诲☉妯锋婵鐗婇弫楣冩⒑閸涘﹦鎳冪紒缁橈耿瀵鏁愭径濠勵吅闂佹寧绻傚Λ顓炍涢崟顖涒拺闁告繂瀚烽崕搴g磼閼搁潧鍝虹€殿喛顕ч埥澶娢熼柨瀣垫綌婵犳鍠楅〃鍛存偋婵犲洤鏋佸Δ锝呭暞閳锋垿鏌涘☉姗堝姛闁瑰啿鍟扮槐鎺旂磼濮楀牐鈧法鈧鍠栭…鐑藉极閹邦厼绶炲┑鐘插閸氬懘姊绘担鐟邦嚋缂佽鍊歌灋妞ゆ挾鍊e☉銏犵妞ゆ牗绋堥幏娲⒑閸涘﹦绠撻悗姘卞厴瀹曟洘鎯旈敐鍥╋紲闂佸吋鎮傚ḿ褔宕搹鍏夊亾濞堝灝鏋涙い顓犲厴楠炲啴濮€閵堝懐顦ч柣蹇撶箲閻楁鈧矮绮欏铏规嫚閺屻儱寮板┑鐐板尃閸曨厾褰炬繝鐢靛Т娴硷綁鏁愭径妯绘櫓闂佸憡鎸嗛崪鍐簥闂傚倷鑳剁划顖炲礉閿曞倸绀堟繛鍡樻尭缁€澶愭煏閸繃顥撳ù婊勭矋閵囧嫰骞樼捄鐩掋垽鏌涘Ο渚殶闁逞屽墯椤旀牠宕伴弽顓涒偓锕傛倻閽樺鐎梺褰掑亰閸樿偐娆㈤悙娴嬫斀闁绘ɑ褰冮顐︽煛婢跺﹥鍟炲ǎ鍥э躬閹瑩顢旈崟銊ヤ壕闁哄稁鍋呴弳婊冣攽閻樺弶澶勯柛濠傛健閺屻劑寮撮悙娴嬪亾閸濄儱顥氶柛褎顨嗛悡娆撴煕閹炬鎳庣粭锟犳⒑閹惰姤鏁遍柛銊ユ健瀵鎮㈤崗鐓庢異闂佸疇妗ㄥ鎺斿垝閼哥數绡€缁剧増菤閸嬫捇鎮欓挊澶夊垝闂備礁鎼張顒傜矙閹烘梹宕叉繝闈涱儏绾惧吋绻涢幋鐏荤厧菐椤曗偓閺岋絾鎯旈姀鈺佹櫛闂佸摜濮甸惄顖炪€佸鎰佹▌闂佺硶鏂傞崕鎻掝嚗閸曨垰绠涙い鎺戭槹缂嶅倿姊绘担绋挎毐闁圭⒈鍋婂畷鎰版偡閹佃櫕鐎洪梺鎼炲労閸撴岸鍩涢幒鎳ㄥ綊鏁愰崶銊ユ畬濡炪倖娲樼划搴f閹烘梹瀚氶柟缁樺坊閸嬫挸顫㈠畝鈧禍杈ㄧ節閻㈤潧浠﹂柛銊у枛楠炲﹪鎮欓崫鍕€炲銈嗗坊閸嬫捇宕鐐村仭婵犲﹤鍟扮粻鍐差熆鐟欏嫭绀嬮柟绋匡攻缁旂喎鈹戦崱娆懶ㄩ梺杞扮劍閸旀瑥鐣烽妸鈺婃晩闁芥ê顦竟宥夋⒒娴e憡鎯堢紒澶樺櫍閸┾偓妞ゆ帊鐒﹂悘閬嶆煛閳ь剚绂掔€n偆鍘藉┑顔筋殔濡寮稿☉銏$厽闊浄绲奸柇顖溾偓娈垮枟閹倿銆侀弮鍫濋唶闁绘柨鎼獮妤呮⒒婵犲骸浜滄繛璇х畵楠炴劙骞栨担鍛婅緢闂佹寧绻傚Λ娆撳矗韫囨挴鏀介柣妯诲絻閺嗙偤鏌曢崶銊х畺妞ゃ劊鍎甸幃娆撳级閹存繍娼旈梻浣筋嚃閸ㄥ崬螞閸愵喖鏋侀柟鐗堟緲閻愬﹪鏌嶉崫鍕偓褰掝敊閹剧粯鈷掗柛灞捐壘閳ь剛鍏橀幊妤呭醇閺囩偟鐤囬梺瑙勫礃椤曆囨偪椤曗偓閺屾稖顦虫い銊ユ閹繝鍩€椤掑嫭鈷戦柟绋挎捣缁犳捇鏌熷畡閭﹀剶鐎规洜鏁诲鎾閿涘嫬骞堥梻浣哥秺閸嬪﹪宕㈡ィ鍐ㄎч柟缁㈠枟閻撴盯鎮楅敐搴濋偗闁告瑥瀚伴弻鈥崇暆閳ь剟宕伴幘璇茬劦妞ゆ帒鍊归弳鈺呭几椤忓牆鍐€闁跨喓濮甸埛鎴︽煙缁嬫寧鎹i柍钘夘槺缁辨帞绱掑Ο蹇d邯閿濈偠绠涘☉娆愬劒闁荤喐鐟ョ€氼剟鎮垫导瀛樷拺闁绘劘妫勯崝姘辩棯缂併垹寮柛鈹惧亾濡炪倖甯掗崯顐﹀触瑜版帗鐓冪憸婊堝礈濞嗘挸鍌ㄦ繝濠傜墕绾惧鏌熼崜褏甯涢柣鎾冲暟閹茬ǹ饪伴崼婵堫槶闂佺粯妫冮ˉ鎾诲汲閿曞倹鐓忓璇″灙閸嬫捇鏌涚€n偅宕岄柡浣瑰姈閹棃鍩勯崘顏冩喚闂傚倷鐒︽繛濠囧绩闁秴鍨傞柛褎顨呴拑鐔哥箾閹寸們姘跺绩娴犲鐓曢柍鈺佸枤濞堛垹霉鐏忔牕浜鹃梻鍌氬€峰ù鍥敋瑜忛幑銏犖熼懡銈庢锤闂佸壊鍋呭ú鏍嫅閻斿摜绠鹃柟瀛樼懃閻忣亪鏌涚€n偄濮夐柍褜鍓濋~澶娒洪弽顬℃椽濡舵径濠勫幈閻庡厜鍋撻柛鏇ㄥ厴閹疯櫣绱撻崒娆戝妽閻绱掗崼鏇氭喚闁哄本鐩弫鎰疀閺囩偛鐓傞梻浣风串缁插潡宕楀Ο铏规殾闁跨喓濮甸崐濠氭煕閳╁厾顏堝礂婵犲洦鈷掑ù锝呮嚈閸︻厽宕查柟鐗堟緲妗呭┑鐐叉閹尖晠寮崱娑欑厱闁哄洢鍔岄崢鎾煙妞嬪海甯涚紒缁樼⊕濞煎繘宕滆閸╁矂姊虹涵鍜佸殝缂佽鲸娲熼獮蹇氥亹閹烘挻娅㈤梺缁樏壕顓㈠储閹间焦鈷戦柛娑橈功閻棛绱掗埀顒佹媴閸︻収娲稿┑鐘绘涧閻楀繒澹曢懖鈺冪=濞达綀鐤紓姘箾閸欏灏﹂柡灞剧洴閸╃偤骞嗚婢规洖鈹戦敍鍕杭闁稿﹥鐗滈弫顕€骞掗弬鍝勪壕婵ḿ鍘у顕€鏌熼鍏夊亾閺傘儲顫嶉梺闈涚箚閳ь剚鏋奸崑鎾诲醇閺囩喓鍘介梺褰掑亰閸樿偐寰婃繝姘厓闂佸灝顑嗛ˉ鍫ユ煛鐏炵晫效闁圭ǹ锕ュ鍕熼悜鈺傜€伴梻鍌欑閹碱偊鎳熼婊呯煋闁割偅娲栫粻顖炴煟濡鍤欓柣顓燁殔椤法鎹勯悮瀛樻暰闂佽桨绶℃禍鐐垫閹捐纾兼繛鍡樺笒閸樷剝绻濆▓鍨灓闁轰礁顭烽獮鍡涘礋椤栵絾鏅┑顔结缚閸樠冣枔閵娾晜鈷戦柛锔诲弨濡炬悂鏌涢悩鎰佹疁鐎规洘鍨块獮瀣晜閻e苯甯楅柣鐔哥矋缁挸鐣峰⿰鍫熷亜濡炲瀛╁▓鎯ь渻閵堝棛澧瑙勬礋瀹曟垿骞樼紒妯绘珳闁硅偐琛ラ崜婵嬫倶瀹ュ鈷戦柟鎯板Г閺侀亶鎮介娑樻诞婵犫偓娓氣偓濮婃椽骞愭惔锝囩暤闂佺懓鍟跨换妯虹暦椤栫偞鍊烽柣鎴炨缚閸橀潧顪冮妶鍡欏婵ǜ鍔嶉弲鍫曟晝閸屾稓鍘搁悗鍏夊亾閻庯綆鍓涢惁鍫ユ倵鐟欏嫭绀€闁靛牊鎮傞妴渚€寮撮姀鐙€娼婇梺缁樼憿閸嬫挻绻涢悡搴吋婵﹨娅g槐鎺懳熺拠鑼舵暱闂備胶枪閿曘儳鎹㈤崼婵愬殨濠电姵纰嶉弲鎻掝熆鐠虹尨鍔熼柣顐㈠濮婃椽宕滈幓鎺嶈埅闂佺ǹ顑呴幊妯挎"闂佸搫绋侀崢浠嬪煕閹达附鐓曟繝闈涙椤忣亪鏌ㄥ☉娆愨拻缂佽鲸甯¢幃鈺呮惞椤愩垻锛撻柣搴㈩問閸犳牠鈥﹂悜钘夋瀬闁归偊鍘肩欢鐐测攽閻樻彃顏撮柛鐔奉儔閺岋絾鎯旈妶搴㈢秷濠电偛寮堕悧鏇犲弲闂侀潧鐗嗛ˇ顖涘閻樺磭绠剧€瑰壊鍠曠花濂告煃闁垮鐏撮柟顔挎硾閳藉骞掗崱妞惧闂佺ǹ绻愰幊搴ㄋ夊顓犵瘈闁汇垽娼ф禒婊勩亜閺囥劌骞楅柟渚垮姂楠炴﹢顢氶崨顔芥珗闂備胶纭堕崜婵堢矙閹烘纾婚柛灞剧〒缁犻箖鏌涢埄鍏╂垹浜告导瀛樼厓闂佸灝顑呴悘锕傛煏閸パ冾伃妤犵偞锕㈠畷锟犳倷瀹割喚鈧兘姊绘担椋庝覆缂傚秳鐒︾粋宥夊醇閺囩偟鐣烘繛瀵稿Т椤戞劙寮鍡曠箚妞ゆ牗纰嶉幆鍫熴亜椤掆偓椤戝顫忓ú顏呭仭闁哄娉曟鍥⒑鐠団€虫灈闁稿﹥鎮傞、姘舵晲婢舵ɑ鏅㈤梺閫炲苯澧撮柛鈹垮灪閹棃濡搁敃鈧埀顒勬敱閵囧嫰骞掗幋婵冨亾婵犳艾鐓濆璺号堥弨浠嬫煟濡櫣浠涢柡鍡忔櫊閺屾稓鈧綆鍋嗛埥澶愭懚閿濆應鏀介柣妯诲絻閺嗙喐銇勯埡浣哥骇缂佺粯绻冪换婵嬪磼濮橀棿鎮f俊鐐€栧ú鐔哥閸洖钃熼柨婵嗘啒閻斿吋鍤冮柍杞拌兌椤愬ジ姊绘担铏瑰笡闁规瓕顕х叅闁绘梻鍘ч拑鐔兼煥閻斿搫孝闁绘劕锕弻鏇熷緞閸繂濮庡銈庡墮閻楀﹦鎹㈠┑瀣厱闁逞屽墰娴狅箓鎳為妷褌鎲鹃梻鍌欑窔濞佳兠洪妶鍥e亾濮樼厧寮鐐叉瀵噣宕煎┑鎰秱闂備線娼х换鍡涘焵椤掆偓閸熷潡鎮橀垾鏂ユ斀闁绘ɑ鍓氶崯蹇涙煕閻樺磭澧甸柡浣稿暣婵$兘濡烽钘夌槣闂備浇濮ら敋妞わ箓浜跺鎶芥晝閸屾稓鍘繝鐢靛Т缁绘劙銆呴鍌滅<闁抽敮鍋撻柛瀣崌濮婄粯鎷呴崨濠傛殘闂佸憡姊归崹鍨暦濠靛棭鍚嬮柛娑变簼閻忎礁顪冮妶鍡楀Ё闂傚嫬瀚伴崺娑㈠箳閹炽劌缍婇弫鎰板川椤斿吋娈橀梻浣侯攰鐏忔瑦鐏欓梺瀹狀潐閸ㄥ潡銆佸▎鎾村€锋い鎺嶇劍閻︽捇姊绘担绛嬪殐闁哥噥鍋婂畷鍫曞Ω閵夈倖鐫忕紓鍌氬€搁崐鐑芥倿閿曞倹鏅┑鐐差嚟婵數鏁幒妞烩偓鏃堝礃椤斿槈褔鏌涢埄鍐$細闁挎稒娲熷铏圭矙濞嗘儳鍓遍梺瑙勬倐缁犳牠宕洪埀顒併亜閹烘垵鏋ゆ繛鍏煎姈缁绘盯宕f径娑溾偓鍧楁煛娴gǹ鏆e┑顔瑰亾闂侀潧鐗嗛幊鎰鐎n喗鈷戦柟绋垮缁€鈧梺绋匡工閹芥粎鍒掓繝姘櫜濠㈣泛顑囬崢浠嬫⒑瑜版帒浜伴柛銊ゅ嵆閹啴鎼归崷顓狅紲闂佽褰冮鍥偩閸偅鍙忓┑鐘插亞閻撹偐鈧娲樼敮鎺楀煝鎼淬劌绠i柣姗€娼ф惔濠囨⒒閸屾瑧绐旈柍褜鍓涢崑娑㈡嚐椤栨稒娅犲ù鐓庣摠閻撴洟鎮楅敐搴′簽婵炲弶鎸抽弻鐔风暦閸パ勭亪濡炪們鍨虹粙鎴﹀煡婢跺ň鏋庨柟閭﹀枛婵炲洭姊绘担绛嬪殭閻庢稈鏅濈划娆撳箳濡や焦娅囬梺瀹犳〃鐠佹煡寮搁弬妫靛綊鎮╁顔煎壉闂佺粯鎸鹃崰鏍蓟閻斿吋鐒介柨鏇楀亾妤犵偞鐗滅槐鎺楀箵閹烘繄鍚嬮梺鍝勭焿缁绘繂鐣烽崡鐐嶇喖宕楅悡搴㈢彴闂傚倷绀侀幖顐︽嚐椤栨粎鐭撻柛顐f礀缁狀垶鏌eΟ娆惧殭闁藉啰鍠栭弻鏇熷緞閸繂濮庨梺鍛婄懃閿曘儲绌辨繝鍥ч柛銉仢閵夆晜鐓曢悗锝庡亞濞插瓨銇勯姀锛勫鐎垫澘瀚伴獮鍥敆閸屾粍姣囧┑鐘垫暩閸嬫稑螞濞嗘挸绠板┑鐘宠壘閸氬綊鏌熺€电ǹ浜煎ù婊勭矒閺岀喖鎮滃Ο铏瑰帎闂佸憡姊婚崰鎾绘儉椤忓牜鏁囨繛鎴灻兼竟鏇㈡⒒閸屾艾鈧悂宕愰幖浣哥9闁归棿绀佺壕鐟邦渻鐎n亝鎹i柣顓炴閵嗘帒顫濋敐鍛婵°倗濮烽崑鐐烘偋閻樻眹鈧線寮村杈┬㈤梻浣规偠閸庢椽宕滃鑸靛€块柤娴嬫杹閸嬫捇鐛崹顔煎闂佺娅曢崝娆撳极瀹ュ應妲堥柕蹇婃閹疯櫣绱撻崒娆戝妽閽冮亶鏌i幘鍗炲姦闁哄瞼鍠庨湁閻庯急鍐у闂佸搫鍊堕崕鏌ユ倵濞差亝鈷戠紓浣光棨椤忓牆鍌ㄩ柡宥庡亝瀹曟煡鏌涢埄鍐姇闁绘挸绻橀弻娑㈩敃閿濆洨鐣洪梺闈╃稻濡炰粙寮诲☉銏℃櫜闁糕剝菧娴犮垽姊洪崫鍕拱缂佸甯¢獮鍡涘籍閸繍娼婇梺鐐藉劚绾绢參鏁嶉幘缁樷拻濞达綀娅g敮娑㈡煙鐏忔牗娅婄€规洘鍨剁换婵嬪磼濠婂嫭顔曢梻浣稿閸嬪懎煤閺嶃劌鍔旈梻鍌欑劍鐎笛冾潖瑜版帒纾块柛鎰▕閸ゆ洟鏌熷▓鍨灓缁惧彞绮欓弻娑氫沪閸撗勫櫗缂備椒鑳舵晶妤呭Φ閸曨垰鍗抽柛鈩冾殔閹晜绻涢幋鐐冩岸寮ㄦ禒瀣€甸柨婵嗙凹濞寸兘鏌熼懞銉︾婵﹥妞介獮鎰償閿濆洨鏆ゆ俊鐐€х€靛矂宕瑰畷鍥у灊閻犲洦绁村Σ鍫ユ煏韫囥儳纾块柛姗€浜跺Λ鍛搭敃閵忊€愁槱闂佸湱枪椤兘鐛径鎰濞达絽婀遍崢浠嬫⒑鐎圭姵銆冪紒鑸靛哺瀹曪綁宕熼浣稿伎婵犵數濮撮崯顖炲Φ濠靛鐓涢悘鐐跺Г閸ゅ洭鏌熼鐣屾噰闁瑰磭濮烽幑鍕瑹椤栨瑧纾惧┑鐘垫暩婵參骞忛崘顏冩勃闁伙絽濂旈悽鑽ょ磽閸屾瑨鍏岀紒顕呭灦閹嫰顢涘杈ㄦ闂佹寧绻傚Λ妤冩閻愮鍋撻崗澶婁壕闂侀€炲苯澧撮柟顔瑰墲瀵板嫭绻涢姀鈩冾棃闁诡喒鏅犲Λ鍐ㄢ槈濡や礁濯伴梻鍌欑劍閹爼宕濆鍥e亾缁楁稑娲ょ粻鐐烘煏婵炵偓娅呴柣鎺戠仛閵囧嫰骞掗幋婵愪痪闂佺粯鎸鹃崰鎰┍婵犲浂鏁嶆繝闈涙閹偞绻濋埛鈧仦钘夘潽闂侀€涚┒閸斿秶鎹㈠┑瀣<婵犲﹤鎲涢妸銉庢棃鎮╅棃娑楃捕缂備胶绮敋闁伙絿鍏樻俊鎼佸煛婵犲啯娅撻梻浣告啞閹稿棝宕熼锝囨澖濠电姷顣槐鏇㈠磻閹达箑纾归柡宥庡幗閸嬪淇婇妶鍛櫤闁稿骸瀛╅妵鍕冀椤愵澀绮堕梺鍝勵儎閻掞妇鎹㈠┑鍥╃瘈闁稿本纰嶅▓婊堟⒑鐞涒€充壕婵炲濮撮鍡涙偂閵夛妇绠鹃柟瀵镐紳椤忓牜鏁傞柍杞版€ラ悷鎵冲牚闁告劧绠戞禒顕€姊洪崫鍕拱缂佸甯為幑銏犫攽鐎n亞顦ㄥ銈呯箰鐎氀囧箯閿熺姵鈷掑ù锝堝Г閵嗗啰绱掔拋鍦瘈鐎规洘濞婇弫鎰緞鐏炵晫銈﹂梻浣告贡閸庛倝宕甸敃鍌氱睄闁割偅绻勯崝锕€顪冮妶鍡楃瑨闁稿﹥鎮傝棢婵ǹ鍩栭悡鏇㈡煥閺冨浂鍤欐鐐搭殜閺屾盯鎮╅崘鎻掝潚闂佸搫鐭夌徊鍊熺亙闂侀€炲苯澧撮柟顔ㄥ洤骞㈡繛鎴炵懅閸樻帒鈹戦悩璇у伐闁硅櫕鍔楁竟鏇㈡偩鐏炵ǹ浜炬鐐茬仢閸旀碍淇婇锝団姇闁哄懎鐖奸幃浠嬪川婵犲嫬骞愰柣搴″帨閸嬫捇鎮楅敐搴″闁伙箑鐗撻幃妤冩喆閸曨剛顦ラ梺缁樼墪閸氬绌辨繝鍥ㄥ€婚柦妯猴級閵娧勫枑鐎光偓閸曨剙鍓﹀銈呯箰閻楀﹪鍩涢幒鎳ㄥ綊鏁愰崼鐕佷哗闁汇埄鍨遍惄顖炲蓟閻旇櫣鐭欐繛鍡楀⒔閸氬姊虹拠鈥虫灓闁稿繑锕㈠畷娲晸閻樻彃绐涘銈嗘尨閸撴繈骞夋导瀛樷拻濞达綀娅g敮娑欐叏婵犲偆鐓奸柛鈺傜洴瀹曞ジ濡烽妷锔锯偓顒勬倵楠炲灝鍔氭い锔垮嵆閹繝寮撮姀锛勫帗闂佸疇妗ㄧ粈渚€寮搁妶鍡欑闁割偆鍠愮粈瀣煛鐏炲墽娲撮柡浣瑰姍瀹曞崬螣闂€鎰闂傚倷绀侀幖顐︽儔婵傜ǹ绐楅柡宥庡幘瀹撲線鏌熼幑鎰靛殭缂佺姵濞婇弻鐔衡偓鐢登规禒婊堟煃瑜滈崜锕傚垂瀹曞洦顫曢柟鎯х摠婵挳鏌ц箛鏇熷殌缂佹绱曠槐鎾存媴缁涘娈梺绋匡工濞尖€崇暦濞差亜顫呴柕鍫濇噽椤旀帡鏌i悩鍙夊鐟滄澘鍟撮幃妤咁敇閻戝棙瀵岄梺闈涚墕濡瑩鎮¢妷褎鍠愰柟娈垮枛娴犻亶鏌熼鍨撶紒缁樼箓椤繈顢樺☉娆忣伜婵犵數鍋犻幓顏嗗緤閸ф纾块柕鍫濐槸閸氬綊鏌嶈閸撶喎顫忛搹瑙勫枂闁告洦鍘归崑鐐烘⒑閸涘﹥灏扮紒璇插楠炴垿濮€閻橆偅顫嶅┑鐐叉閸ㄥ綊鎯侀崼銉︹拺缂佸鍎婚~锕傛煕婵犲啯绀€闁崇粯鎹囨俊鎼佸煛閸屾粌骞楅梻浣虹帛閿氱€殿喛鍩栧鍕礋椤撶姷锛滄繛杈剧秬椤绱為幋锕€纭€闂侇剙绉甸悡鏇熴亜閹扳晛鈧洟寮稿鍥╃<閻犲洤寮堕ˉ鐐烘煏閸パ冾伃鐎殿喕绮欓、鏇綖椤撶喎濯伴梻鍌欐祰濡椼劎娆㈠顓狀洸闁割偅娲栭拑鐔兼煥閻斿搫孝缁炬儳鍚嬫穱濠囧Χ閸屾矮澹曞┑鐐茬摠缁挾绮婚弽褜娼栧┑鐘宠壘绾惧吋鎱ㄥ鍡楀幋闁稿鎸婚ˇ鐗堟償閿濆洨鍔跺┑鐐存尰閸╁啴宕戦幘鎼闁绘劕妯婂Ο鈧梺鎼炲妼婢т粙骞栭悙顒佸閻熸瑥瀚ㄦ禒銏ゆ⒑鏉炴壆顦﹂柛鐔告綑閻g兘骞掗幋顓熷兊闂佽褰冮鍥嵁閵忋倖鈷掗柛灞剧懅椤︼箓鏌熷ù瀣у亾鐡掍焦妞介弫鍐磼濮橀硸妲舵繝娈垮枟鏋繛澶嬬洴閹苯螖閸涱垰褰勯梺鎼炲劘閸斿酣鍩婇弴銏$厽闁规儳纾粻濠氭煟閹垮啫浜扮€规洖鐖兼俊鎼佹晜缂併垺袣濠碉紕鍋戦崐鏇燁殽閹间礁瀚夋い鎺戝€瑰畷鍙夌箾閹存瑥鐏╃紒鐘差煼閺岀喐锛愭担钘夊帯闂佸憡鑹鹃澶婎潖濞差亜浼犻柛鏇ㄥ墯閹峰崬鈹戦悙璺虹毢闁哥姴閰i幃楣冩倻閼恒儱浜楅柟鐓庣摠钃遍柡鍌楀亾闂傚倷鐒﹂幃鍫曞磿閹绢喖鏄ラ柡宥庡幗閺咁剙銆掑锝呬壕濠殿喖锕︾划顖炲箯閸涘瓨鎯為柣鐔稿椤愬ジ姊绘担鍛婅础閺嬵亪鏌i弽顐㈠付闁伙絿鍏樺鎾閻樼儤鎲伴梻渚€娼чˇ顓㈠磿濞嗘挻鏅濋柛灞剧〒閸橀亶姊洪崫鍕偍闁告柨鐭傞幃姗€鏁撻悩宕囧幐闂佸憡渚楅崰姘辩不閻愮儤鐓涢悘鐐插⒔閵嗘帒霉閻欏懐鐣电€规洘绮忛ˇ顔尖攽椤斿吋鍠樻慨濠勭帛閹峰懐鎷犻垾鍐插闂備礁鎲¢敋闁靛牊鎮傞崹楣冨籍閸繄顦ㄥ銈嗘煥濡插牐顦规鐐寸墱閸掓帡宕楁径濠佸闂佽偐鈷堥崜娑樷枖鐠恒劎纾介柛灞捐壘閳ь剛鍏橀幊妤呭礈娴gǹ鐏婂銈嗙墱閸嬬偤寮插┑瀣厪闊洤顑呴埀顒侇殔閻e灚绗熼埀顒勫蓟閳ユ剚鍚嬮幖绮光偓鍐茬濠电偛鐡ㄧ划宀€绱炴繝鍥ц摕闁绘柨鍚嬮崐缁樹繆椤栨繃顏犲ù鐘虫倐閹鎲撮崟顒€纰嶇紓浣割槹閹告娊鍨鹃弮鍫濈妞ゆ柨妲堣閺屾盯鍩勯崗鐙€浜鍐参旀担铏圭槇濠电偛鐗嗛悘婵嬫倶閻樼偨浜滈柡鍥ュ妼楠炴牠宕¢柆宥嗙厵闁绘鐗婄欢鏌ユ煟椤撶噥娈旀い顓℃硶閹瑰嫰鎼归崷顓濈礃闂備椒绱粻鎴︽偋韫囨洘顫曢柟鐑橆殔缁€鍫㈡喐瀹ュ鈧倹绺介崨濠傜彅闁哄鐗勯崝濠冪濠婂嫨浜滈柟鏉跨仛缁舵盯妫呴澶婂⒋闁哄矉绱曟禒锕傚礈瑜庨崚娑欑節绾版ê澧查柟顔煎€规穱濠囨偪椤栵絾顎夌紓鍌欐祰娴滎剟宕戦妶鍜佹綎婵炲樊浜滃婵嗏攽閻樻彃鈧鎮烽弻銉︾厽闁靛繆鏅涢悘鑼磼缂佹ḿ绠炲┑鈥崇摠閹峰懐鍖栭弴鐕佹綌闂備線娼х换鍡涘焵椤掍焦鐏遍柛瀣崌閹粓鎳為妷褍骞樼紓浣哄亾濠㈡ê鐣烽浣规珷闁告挆鍛紲闁哄鐗冮弲婊堝汲椤掍焦鍙忓┑鐘插鐢盯鏌熷畡鐗堝櫧缂侇喚鏁搁埀顒婄秵閸嬪棛绮旈悜鑺モ拻濞达絽鎳欓悷閭︽僵闁挎洍鍋撻柍璇茬Ч瀵挳濮€閻樺灚鐓i梻浣藉亹鏋柣蹇斿哺瀹曟洟鎮㈤崗鑲╁弳濠电娀娼уΛ娆愬垔閸忛棿绻嗘い鎰剁悼閻帗鎱ㄦ繝鍐┿仢闁瑰磭鍋ゆ俊鐑藉礃閸欍儵鍋楅柦妯煎枛閺屾洝绠涢妷褏銈锋繛瀛樼矊缂嶅﹪寮婚悢鍏煎€绘俊顖濐嚙闂夊秴鈹戦悙鍙夊櫤缂侇喗鎸搁~蹇撁洪鍕獩婵犵數濮撮崯顐λ囬埡鍛拺闁告稑饪甸懓璺ㄧ磼閻樺磭澧垫鐐插暣閺佹捇鎮╅懠顒夊晪缂傚倸鍊烽悞锕佸綔闂佸綊鏀卞钘夘潖濞差亜宸濆┑鐘插濡插牓姊洪幐搴㈢┛濠碘€虫川閸掓帞鎷犲顔藉缓闂侀€炲苯澧寸€殿喛顕ч埥澶娾枎閹邦剙濡虫繝鐢靛仦閸ㄦ儼褰滈梺绋款儐閹告瓕鐏冮梺鍛婁緱閸橀箖顢欐径鎰拺闂傚牊绋撶粻鍐测攽椤曞懎骞栭崡閬嶆煕椤愮姴鍔滈柣鎾崇箻閻擃偊宕堕‖锝呯墦瀹曟垿骞樼紒妯诲劒濡炪倖鍔﹂崑鍕箖鐎n偆绡€缁炬澘顦辩壕鍧楁煕鐎n偄鐏寸€规洘鍔欏鍊燁檨闁哥喎鎳庨埞鎴︽偐鐎圭姴顥濈紒鐐劤椤兘寮婚悢鐓庣鐟滃繒鏁☉銏$厽闁规儳顕ú鎾煙椤旂瓔娈滈柡浣瑰姈閹棃鍨鹃懠顒佹櫦闂傚倷绶氬ḿ褍螞濞嗘垶鏆滈柨鐔哄Т閽冪喓鈧箍鍎遍悧婊冾瀶閵娾晜鈷戦柛娑橈攻鐏忔壆绱掔拠鑼ⅵ闁轰焦鍔欓幃娆撳级閹寸姷鐛┑鐘垫暩閸嬬偟鏁幒妤€绠规い鎰╁劤娴滆棄鈹戦悙瀛樺鞍闁告垵缍婂畷瑙勬綇閳规儳浜鹃梻鍫熺⊕濠€鎵磼缂佹ḿ銆掗柍褜鍓涢弫鍛婄仚閻庢稒绻傞—鍐Χ閸℃浠撮梺纭呮珪閿氭い鏇稻鐎靛ジ寮堕幊鐐藉姂閺屽秹宕崟顐熷亾婵犳艾鍌ㄩ柟鍓х帛閸嬧剝绻濇繝鍌氼伀闁活厽甯為埀顒冾潐濞叉ḿ鍒掑畝鍕剁稏婵犻潧鐗婂畷澶娒归敐鍡樼┛缂佺姵鎹囧璇测槈閵忕姴宓嗛梺闈浨归崕铏閳哄啰纾藉ù锝呮惈瀛濈紒鍓ц檸閸欏啴宕洪埀顒併亜閹哄棗浜剧紓浣哄Т缁夌懓鐣烽弴銏$劶鐎规挶鍎卞ú锔锯偓闈涖偢楠炴牠顢橀悢鍛婄彅闂傚倷绀侀幖顐ょ矓閺屻儱绀夐幖杈剧悼娑撳秴螖閿濆懎鏆為柛濠傜仛缁绘盯骞嬮悙鍨枟缂傚倸鍊瑰畝鎼佸蓟閿濆鏁囬柣鎴濇閸撳磭绱撴担浠嬪摵閻㈩垽绻濋妴浣糕枎閹炬潙娈熼梺闈涱槶閸庢娊鏁嶉幘缁樼厽閹兼番鍩勯崯蹇涙煕閻樺磭澧甸柍銉畵閹粓鎸婃径宀€鏆梻渚€娼х换鍫ュ磹閺嶎厼纾婚柛宀€鍋涚粻褰掓倵濞戞瑡缂氱紒鐘筹耿閺岋綁骞囬濠呭惈濠殿喖锕︾划顖炲箯閸涙潙宸濆┑鐘插€瑰▓妯荤節閻㈤潧浠╂い鏇熺矌缁骞樺畷鍥ㄦ濠电姴锕ら悧濠囧疾濠靛鐓冪憸婊堝礈濠靛鍊堕悗锝庡枟閳锋垹绱撴担濮戭亝鎱ㄩ崶銊d簻闁哄洢鍔岄獮妯肩磼椤斿墽甯涢柕鍫秮瀹曟﹢鍩℃担鎻掍壕闁割煈鍋嗙粻楣冩煙鐎电ǹ浠ч柟鑼櫕缁辨捇宕掑☉妯烘懙闂佸搫鐭夌紞渚€銆佸鈧幃婊堝幢濡も偓婢瑰酣姊绘担鍛婃儓闁哄牜鍓涚划娆撳箳濡も偓缁犳岸鏌¢崘銊у妞ゎ偄鎳橀弻锝咁潨閸℃ぞ绨奸梺璇茬箰濡繂顫忕紒妯诲闁惧繐绠嶉埀顒€锕弻锟犲川椤斿墽鐤勯悗瑙勬礃閸ㄦ寧淇婇懜闈涚窞閻忕偟鏅妶锕傛⒑鐠囨彃鍤辩紓宥呮瀹曟澘螖閸涱厾鏌у┑鐘诧工閻楀﹪鎮¢姀鈥茬箚妞ゆ牗鐟ㄩ鐔镐繆閺屻儲鏁遍柟渚垮妿閹叉挳宕熼崹顐ゆ殾濠电儑绲藉ú銈夋晝椤忓牆绠栨繛鍡樻惄閺佸倿鏌涢弴妯哄濞存粓绠栭弻鈥愁吋鎼粹€崇缂備讲鍋撳鑸靛姈閻撱儵鏌¢崶顭戞當濞存粍鍎抽—鍐Χ鎼粹€崇濠电偟銆嬬换婵嗙暦濞差亜鐒垫い鎺嶉檷娴滄粓鏌熼崫鍕棞濞存粍鍎抽—鍐Χ鎼粹€崇哗濠电偛顦板ú鐔肩嵁婢舵劕绠绘い鏃囧亹椤︽澘顪冮妶鍡楃瑨闁稿妫楀嵄閻熸瑥瀚弧鈧┑鐐茬墕閻忔繈寮稿☉銏$叆闁哄洦锚閳ь剚绻堥崹楣冩晝閳ь剟鎮鹃敓鐘茬妞ゆ棁濮ら鏇㈡⒒娴e憡璐¢柛搴涘€濆畷褰掓偄閻撳骸鍤戦柟鍏肩暘閸斿秹鎮″▎鎾崇骇闁割偅绻傞埛鏃堟煙椤旂鍋㈤柡宀嬬到閳藉寮借婵箑鈹戦纭峰姛缂侇噮鍨堕獮蹇涘川閺夋垵绐涙繝鐢靛Т閸婄懓鈻撳鈧缁樻媴閸涘﹨纭€闁哄浜濋妵鍕敇閻樻彃骞嬪Δ鐘靛仜閸熸挳骞冮崸妤婃晬闁挎繂鏌婇鍕拻濞达絽鎲¢崯鐐烘偨椤栨侗娈橀柡渚囧櫍閸ㄩ箖骞囨担鍛婎吙婵$偑鍊栧ú宥夊磻閹惧灈鍋撶憴鍕閻㈩垱甯熼悘鍐⒑闁偛鑻晶顖滅磼閸屾氨校闁靛牞缍佸畷姗€鍩¢崘銊ョ闂傚倷绶氬ḿ褏鎹㈤崼銉ュ瀭婵炲樊浜堕弫鍌炴煏韫囧鐏柛鐘冲姍閺岋絽螖閳ь剟鎮ч崱娑樿Е闁荤喖鍋婇悢鍡涙偣妤﹁¥鈧偓闁活亜顑嗙换娑氫焊閺嶃劍鐝氶梺鍝勮閸婃繂鐣烽锕€唯闁挎棁濮ら惁搴ㄦ⒒娴e憡鍟為柨鏇樺灪缁傚秹宕奸弴鐐电暫閻庣懓瀚竟瀣醇椤忓牊鐓曢柟浼存涧閺嬫稓鈧鍠曢崡鍐差潖濞差亝顥堟繛鎴炵懐濡偤姊洪崫銉ユ瀾婵炲吋鐟╅幃楣冩倻閽樺顢呴梺缁樺姀閺呮粓锝炲鍛斀闁绘劕寮堕ˉ婊呯磼鐠囧樊鍎戦柤娲憾瀹曞綊顢曢妶鍥╂闂備焦鐪归崹钘夅缚瑜庣粋鎺戔堪閸曨亞绠氬銈嗗姧缁插潡骞婇崶顭戞闁绘劖娼欐慨鍫㈢磼缂佹ḿ绠撴い顐g箞椤㈡宕掗敂鍙ヨ闂傚倸鍊烽悞锕傛儑瑜版帒鍨傜憸鐗堝笒缁犵喖鏌ㄩ悢鍝勑i柛瀣€块弻锝夊棘閸喗鍊梺缁樻尭缁绘﹢鎮¢锕€鐐婄憸婊堝磿韫囨稒鐓熼煫鍥风导缁ㄥジ鏌曢崶褍顏紒鐘崇〒閳ь剨缍嗘禍鐐村閸儲鈷戦悹鍥b偓铏亪闂佹悶鍨洪悡锟犲春閵忊剝鍎熼柕鍫濇川閺夋悂姊洪悷鎵虎闁哥啿鏅濆Σ鎰板箣濠靛啯鏂€闂佺粯锕╅崑鍛垔娴煎瓨鐓冪憸婊堝礈閻旂厧鏄ラ柍褜鍓氶妵鍕箳瀹ュ洤濡介梺璇茬箻娴滃爼寮婚敓鐘茬劦妞ゆ帊鑳堕々鐑芥倵閿濆骸浜為柛娆忔閳规垿鎮欓弶鎴犱桓闂佹寧纰嶉妵鍕疀婵犲啯鐝旈梻鍥ь槹缁绘繃绻濋崒姘闂佺ǹ顑冮崹浠嬪蓟閿涘嫪娌柛鎾椻偓婵洨绱撴担铏瑰笡闁烩晩鍨伴悾鐤亹閹烘繃鏅╅梺鑽ゅ枛椤o附绔熼弴鐐╂斀闁绘ḿ绮☉褎淇婇锝囨创鐎殿喗濞婇弫鍐磼濞戞艾骞嶉梺鍝勵槸閻楀棙鏅舵禒瀣仼閺夊牃鏂侀崑鎾绘偡閻楀牆鏆堢紓浣筋嚙閸熷瓨淇婇悽绋跨妞ゆ牗姘ㄩ濠囨⒑閸濆嫬鈧悂鎮樺┑鍥╊浄婵せ鍋撴慨濠冩そ瀹曠兘顢樺☉娆忕彵闂備胶枪椤戝懘藝閻㈢ǹ绠栨慨妞诲亾妤犵偞甯掕灃濞达絽寮剁€氳偐绱撻崒娆戭槮妞ゆ垵鐗嗛埢鏃堝即閻樺吀绗夐梺瑙勫劶婵倝鎮¢弴鐔剁箚妞ゆ牗绮屽瓭闁诲孩鍑归崣鍐ㄧ暦閺囥垺鍋勯悘蹇庣劍閺傗偓闂備胶绮摫鐟滄澘鍟撮崺鈧い鎺戝€归弳顒傗偓娈垮枔閸斿秶绮嬮幒鏂哄亾閿濆骸浜為柛妯挎閳规垿鍩ラ崱妤冧淮闂佺ǹ顑嗛崝妤呭极椤斿皷妲堟繛鍡樺灩椤旀洟姊洪悷鏉挎毐闁搞垼灏欓埀顒佸搸閸斿秶绮嬪鍛牚闁割偆鍠撻崢鐢告煟鎼淬垻鈯曞畝锝堟硶缁寮介妸锝勭盎闂侀潧顧€缁蹭粙鎮橀弻銉︾厵缂佸灏呴煬顒勬煙椤斿搫鐏茬€规洘顨婇幊鏍煛娴e摜鐤勬繝纰夌磿閸嬫垿宕愰弽顓炵闁硅揪绠戠壕褰掓煛閸ャ儱鐏╅柛鎴犲█閺岋繝宕橀妸銉㈠亾閼姐倕顥氬┑鍌氭啞閻撶喐淇婇姘变虎闁告艾缍婇弻锝夋晲閸℃ǜ浠㈤梺鍝勫閳ь剙纾弳鍡涙煃瑜滈崜鐔风暦娴兼潙绠婚悹鍥皺閸旓箑顪冮妶鍡楃瑐闁煎啿鐖奸崺濠囧即閻愬灚娈曢梺鎸庣箓閻楀﹦娑甸崜浣虹<妞ゆ梻鈷堥悡鍏碱殽閻愮榿缂氱紒杈ㄥ笒铻i柣鎾抽缁犺崵绱撻崒姘偓椋庣矆娓氣偓椤㈡牠宕煎┑鍐╃亙闂佸搫娲ㄦ慨鐑芥儗閹惧绠剧€瑰壊鍠曠花濂告煟閹惧娲撮柟顔斤耿閹瑩骞撻幒鍡樺瘱婵犵數鍋炶ぐ鍐偤閵娾斂鈧啴濡烽埡鍌氣偓鐑藉级閸喎绀冮柍褜鍓氱€笛囥€冮妷鈺傚€烽悗娑櫭壕鍐参旈悩闈涗沪閻㈩垽绻濋悰顔锯偓锝庡枟閸嬫劖銇勯弮鍫燂紵缂侇噯绻濆濠氬磼濮橆兘鍋撻幖浣哥9濡炲娴烽惌鍡椼€掑锝呬壕濡ょ姷鍋為悧鐘汇€侀弴銏℃櫆闁芥ê顦竟鎺戔攽閻橆喖鐏辨繛澶嬬洴閹崇喖顢涘⿰鍕靛仺闂侀潧鐗嗛幉姗€寮崼鐔告珳闂佸憡渚楅崢钘夆枔椤撶姷纾藉ù锝呮惈鏍¢悗鍏夊亾闁归棿绀侀拑鐔兼煥閻斿搫孝缂佲偓閸愵喗鐓忓┑鐐戝啫鏋ら柡鍡╁亝娣囧﹪鎮欓鍕ㄥ亾閵堝纾婚柛鏇ㄥ灠缁犵姵鎱ㄥ璇蹭壕閻庢鍠栭…閿嬩繆閹间礁唯闁靛繆鍓濋弶鎼佹⒒娴h櫣銆婇柛鎾寸箞閺佸顪冮妶鍛劉缂佸鍨块崺鐐哄箣閿曗偓閻擄繝鏌涢埄鍐︿沪缂併劋绮欏娲传閵夈儛锝夋煕閺冣偓閻楁粎鍒掑顓熺秶闁靛ě鍛闂備焦鎮堕崕顖炲礉瀹€鍕劦妞ゆ帒瀚弫閬嶆煏閸パ冾伂缂佺姵鐩獮姗€骞囨担閿嬵潟闂傚倷鑳舵灙妞ゆ垵妫濋獮鎴炵瑹閳ь剝妫熼柣搴ㄦ涧閹芥粎澹曟總绋跨骇闁割偅绋戞俊浠嬫倶韫囷絽骞楅柕鍥у椤㈡洟鏁愰崶鈺冩毉闂備礁婀遍幊鎾垛偓姘嵆楠炴牠宕烽鐔风彴闂佹枼鏅涢崯顖炲汲韫囨稒鈷掗柛灞捐壘閳ь剛鍏橀幃鐐烘晝閸屾氨锛熼梺鍛婂姌椤ュ棝鎮烽柇锔藉兊闁荤娀缂氬▍锝夋晬濞戙垺鈷戠紒瀣濠€鎵磼椤旇偐孝闁伙絿鍏樺濠氬Ψ閿旀儳骞堥梻浣规灱閺呮盯宕导鏉戠厐闁哄洢鍨洪悡鐔兼煙閹规劖纭鹃柡瀣洴閺岋紕浠﹂悙顒傤槷缂備胶濮电粙鎺旀崲濠靛绀冮柕濠忓閺嗩垶姊婚崒娆戠獢婵炶壈宕甸埀顒勬涧閻倸鐣烽姀掳鍋呴柛鎰ㄦ櫅閸撳綊姊虹化鏇炲⒉缂佸甯″畷鎰版偨閸涘﹦鍙嗗┑鐘绘涧濡繈顢撳Δ鈧湁婵犲﹤瀚晶顏堟婢跺绡€濠电姴鍊搁顐︽煟椤撶喎娴柡宀嬬磿娴狅妇鍖栭弴鐐板闂佸綊顣︾粈渚€骞冮幋锔解拺闁告稑锕ゆ慨鍌炴煕閺傝法鐒搁柍銉︾墬瀵板嫰骞囬娑欏婵犳鍠氶幊鎾趁洪妶鍡曠箚濞寸姴顑嗛悡鏇㈡煏婵炲灝鍔ら柛鈺嬬到閳规垿鏁嶉崟顒佹瘓閻庤娲滈崰鏍€佸☉姗嗘僵妞ゆ挆鍕垫(闂傚倸鍊风粈渚€骞夐敓鐘冲亗妞ゆ挶鍨瑰洿闂佸憡渚楅崰鏍礈閸偆绡€闁汇垽娼ф牎濡炪倖姊归悧鐘茬暦娴兼潙鍐€妞ゆ挾鍠愬▍鍥⒑闂堟侗妲堕柛搴℃惈閵嗘帞鎷犵憗浣哥秺閹晛顔忛鐓庡缂傚倷鑳舵慨鐢告偋閻樿钃熼柨婵嗩槸缁狅綁鏌ㄥ┑鍡橈紞婵☆偄瀚槐鎾存媴閸濆嫅鐐烘煕鎼淬垻鍙€濠碉紕鏁诲畷鐔碱敍濮樿京娼夐梻浣规偠閸庢椽鎮樺┑瀣缂備焦岣块崢閬嶆⒑缂佹◤顏嗗椤撶喐娅犻弶鍫氭櫇绾惧ジ寮堕崼娑樺鐎规洖鐬奸埀顒冾潐濞叉ḿ鏁幒妤€鐓濋幖娣妼缁狅絾绻濋棃娑欙紞闁诲孩娼欓埞鎴︽偐濞堟寧娈扮紓浣介哺濞茬喎鐣烽幋锔藉亜闁绘挸娴烽弻褍顪冮妶鍡楀闁稿﹥娲熷畷鐟扳攽閸″繑鏂€闂佺粯锚閻ゅ洦绔熷鈧弻娑㈠箛閵娿儰澹曢梻浣藉吹閸犳劗鍒掑畝鈧幑銏犖熸笟顖氭闂佽鍎兼慨銈夊疾濠靛鐓曢悘鐐插⒔閵嗘帡鏌涘Ο鍏兼毈闁哄备鍓濆鍕節閸曨偒鏆┑鐘媰閸屾粎鐓撻梺璇″枤閸嬫挸岣胯箛娑樼厸闁告劦浜风槐鏌ユ⒒娴h櫣甯涢柨姘繆椤栨熬韬柟顔瑰墲缁轰粙宕ㄦ繝鍕箥婵$偑鍊栧Λ渚€宕戦幇顔剧煋闁惧繐鍘滈崑鎾舵喆閸曨剛顦ラ梺缁樼墪閸氬绌辨繝鍥х濞达綀鍊介妸褎鍠愰煫鍥ㄧ☉鍥撮梺缁樺灱婵倝鎮¢悢鐓庣婵烇綆鍓欓悞娲煕閻旈绠婚柡灞剧洴閹晠宕橀幓鎺撴嚈闁诲氦顫夊ú姗€銆冮崨鎵航濠电偠鎻徊鎯哄鈧幆鍕敍濮樿鲸娈鹃梺闈浥堥弲娑氱不鐟欏嫨浜滈柟鎹愭硾閺嬫垶绻涢崨顓熷枠婵﹦绮粭鐔煎焵椤掆偓宀h儻顦撮柟骞垮灲瀹曞崬鈽夊Ο纰辨Ф婵犵數濞€濞佳囶敄閸涱垳涓嶉柡宥冨妿缁犻箖鏌涢埄鍐炬畷缂佸倸顑嗙换娑㈠箻閹颁胶鍚嬮梺鍝勬湰濞茬喎鐣烽悡搴樻斀闁搞儴鍩栭ˉ锝夋⒒娴g瓔鍤欑紒璇茬墦瀹曟洟鎮界粙璺ㄧ暫濠德板€愰崑鎾淬亜椤愶絿绠為柟顔瑰墲閹棃鍩ラ崱妯荤グ闂傚倸鍊风粈渚€骞栭锕€绠犵€光偓閸曨偆锛熼梻渚囧墮缁夋挳鎮″鈧弻鐔衡偓鐢登规禒婊呯磼閻橀潧鈻堟慨濠呮缁瑩宕犻埄鍐╂毎婵犵數鍋犵亸娆撳窗閺嶎厽鍋樻い鏃傛櫕缁♀偓闂佸憡渚楅崹鎶藉级缁嬪簱鏀介柣鎰綑閻忥箑鐣濋敐鍛仴鐎规洏鍨介弻鍡楊吋閸″繑瀚肩紓浣鸿檸閸樺ジ骞婅箛姘ヤ汗鐟滄柨顫忔繝姘妞ゆ劑鍩勬导鍐⒑鐠団€虫珯缂佺粯绻傞锝夊箻椤旇棄浜滈梺鎯х箰濠€鍗炍i崶顒佲拻闁稿本鑹鹃埀顒佹倐閹勭節閸曨厾鐓撻梺鍦劋椤у倹寰勬繛鎯х墯闂佸憡娲嶉弲娆戣姳婵犳碍顥婃い鎰╁灪缁侇偆绱掗懠璺盒撻柡鍛埣椤㈡盯鎮欑€电ǹ甯鹃梻浣规偠閸庢粓宕橀崣銉х>濠碉紕鍋戦崐鎴﹀垂閸濆娊娲偄缁楄 鍋撴担鑲濇棃宕ㄩ鐙呯床婵犵數濮撮敃銈団偓姘煎弮椤㈡瑩骞樼紒妯锋嫽闂佺ǹ鏈悷褔藝閿曞倹鐓欑痪鏉垮船娴滄壆鈧鍠氶弫濠氥€佸Δ鍛<婵犲﹤鎳愰崢顖炴⒒娴e憡璐¢柛搴涘€濋妴鍐川椤栨粈绗夊┑顔角归崺鏍偂濞戙垺鐓曢柟鎵虫櫅婵″灝顭胯濞叉﹢濡甸崟顖f晝闁靛繆鈧櫕鐣婚梻浣告惈閺堫剙煤濠靛牏涓嶆繛鎴欏灩閸楁娊鏌i幇顓炲闁搞劏宕靛Σ鎰板箻鐎涙ê顎撻梺鍛婄懃椤︿即鎮靛鑸碘拺闁告繂瀚悞璺ㄧ磼閺屻儳鐣烘鐐叉瀵噣宕煎顎板洤绠规繛锝庡墮閻忣喚绱掓径鎰暠缂佺粯绻堥幃浠嬫濞戞鎹曢柣搴㈩問閸犳牠鎮ユ總绋挎瀬闁告劦鍠栭~鍛存煟濡櫣浠涙繛鍫熷劤閳规垿鎮╃紒妯婚敪濠碘槅鍋勯惌鍌氼嚕閸涘﹥鍎熼柕濞у啫绲奸梻浣规偠閸庮垶宕濆鍥╃焼闁告劏鏅濈粻楣冩煕椤愮姴鐏╁ù婊冨⒔缁辨帞绱掑Ο鑲╃杽濠碘槅鍋勯崯顐﹀煡婢跺á鐔风暋妫颁礁顥氱紓鍌氬€烽悞锕€鐜婚幐搴n浄婵ǹ鍩栭埛鎺懨归敐鍛暈闁哥喓鍋為妵鍕Ω閵夛富妫$紓浣虹帛缁嬫帞鎹㈠┑瀣倞鐟滄垿骞楅弴銏♀拺闁圭ǹ娴风粻鎾绘煙閸欏鑰块柟顔哄灲閹粌螣閾忕懓閰遍梻鍌欐祰閸嬫劙鍩涢崼銉ョ婵炴垯鍨瑰洿婵$偛顑呭ù椋庡娴犲鐓曢悘鐐插⒔閹冲懘鏌涢弬璺ㄐら柟鍙夋倐瀵爼宕归鑺ヮ啋濠电姷顣介埀顒€鍟块。宕囩磼椤旂晫鎳冮柍璇查叄閹瑩顢楅崒婧炬瀱缂傚倸鍊搁崐鎼佸磹閻戣姤鍊块柨鏇氱劍閹冲苯鈹戦悩鎰佸晱闁搞劑浜堕獮鎰板箮閽樺鐣洪悗鐟板婢瑰寮告惔銊у彄闁搞儯鍔嶉幆鍕归悩鎻掓倯缂佺粯绋撻埀顒傛暩鏋悮銉╂⒑閸濆嫭鍣藉┑顔芥尦閿濈偠绠涘☉娆愬劒闂侀潻瀵岄崢楣冩偂閹剧粯鈷戦柛鎾瑰皺閸樻盯鏌涢悩瀹犲閸楀崬霉閻撳海鎽犻柍閿嬪灴閺岀喖鎳栭埡浣风捕婵犳鍠掗崑鎾寸節閻㈤潧浠滄い锔垮嵆閹嫰顢涢悙鑼暫闂佽鍨庨崨顔界杺闂備線鈧稓绁锋繛鍛礋瀵剟鍩€椤掑嫭鈷掑ù锝堟閵嗗﹥淇婇悪娆忔搐閻ょ偓绻涢幋娆忕仼缂佺姵鐗犻弻鐔告綇妤e啯顎嶉梺鎶芥敱閸ㄥ潡寮婚悢鍏煎殐闁宠桨妞掔划鍫曟⒑閸涘﹥顥堟繛浣冲洤鐓橀柟杈剧畱閻忔娊鏌ц箛锝呬簻闁哄濞€閹鎲撮崟顒傤槰缂備緡鍠楅幐缁樼┍婵犲洤绠瑰ù锝呮憸閸樻悂姊虹粙鎸庢拱妞ゃ劌妫涢埀顒佷亢閸嬫劗妲愰幘璇茬<婵﹩鍏橀崑鎾绘倻閼恒儱鈧潡鏌ㄩ弴鐐测偓褰掑疾濠靛鐓冮弶鐐村椤斿鏌$€n偅顥堥柡宀嬬節瀹曟﹢濡歌椤も偓闂備胶绮幐楣冨窗閹邦厾鈹嶅┑鐘叉搐鍥撮梺绋挎湰閻喗绔熼弴銏♀拺閻犲洦褰冮銏ゆ煕閹存繄绉虹€规洏鍨藉畷婊嗩槻闁搞劍绻堥幃妤呮晲鎼存繃鍠氶梺鍛婅壘椤戝寮诲☉妯锋闁告瑦岣块惄搴ㄦ⒑缂佹﹩娈曠€光偓缁嬫娼栨繛宸簻缁€鍫ユ煙缂佹ê绗傜紒銊ょ矙濮婃椽宕妷銉愶綁鏌熼悷鐗堟悙闁伙絿鍏樻慨鈧柕鍫濆閺呮粓姊洪崨濠佺繁闁搞劍濞婇幆渚€宕奸妷锔规嫼闂傚倸鐗婇惄顖炴偘濠婂懐纾界€广儱鎳忛ˉ銏⑩偓瑙勬礈閺佽鐣峰鈧、娆撴偩鐏炶棄绠為梻鍌欑窔濞佳勭仚闂佺ǹ锕ュú鏍偩閻㈢ǹ骞㈡繛鍡楄嫰娴滈箖鎮峰▎蹇擃仾濠㈣泛瀚伴弻娑㈠Ω閵壯冪厽濡ょ姷鍋涢崯鎾春閿熺姴绀冮柍杞拌兌瑜版挳姊绘担鍛婅础缂侇噮鍨抽弫顕€骞掗幋鏃€鐏侀梺闈涚墕椤︿即鍩涢幒鎳ㄥ綊鏁愰崨顔兼殘闂佸摜鍠撻崑鐔烘閹烘柡鍋撻敐搴′簻闁诲繑鎸抽弻鐔碱敊閼恒儯浠㈡繝纰樺墲閹倿宕洪埄鍐╁闁告繂瀚粻鐐烘⒒閸屾瑨鍏屾い銏狅躬楠炴捇顢旈崼鐔叉寖闂佸憡娲﹂崹閬嶅磻閸岀偞鐓涢柛銉㈡櫅閺嬫梻绱掗埦鈧崑鎾绘⒒閸屾艾鈧悂鎮ф繝鍕煓闁圭儤顧傛径濞惧牚闁告洍鏅欑花濠氭椤愩垺绁紒鑼跺Г缁傚秵瀵肩€涙ḿ鍘搁悗鍏夊亾閻庯綆鍓涜ⅵ婵°倗濮烽崑鐐垫暜閳ユ剚鍤曢柟缁㈠枟閸嬪嫰鏌熼鐔峰潑闁稿鎸荤换婵嬪礋椤撶媴绱冲┑鐐舵彧缁茶偐鍒掑▎鎾充紶婵炲樊浜濋崑銊︺亜閺嶃儱鈧寮ч埀顒勬⒑鐠団€虫珯缂佺粯绻堥妴渚€寮撮姀鈩冩珕缂傚倷鐒﹁摫婵炲懎绉瑰缁樻媴閾忕懓绗$€光偓閿濆懏鍋ョ€殿噮鍋婇獮鏍ㄦ媴缁嬪灝浜舵俊鐐€栭悧婊堝磻閻愬搫鐓曢柟鐑樺殮瑜版帗鏅查柛顐ゅ櫏娴犫晠姊洪棃娑欘棞闁挎洦浜濠氭晸閻樻彃绐涘銈嗘煥婢т粙鎮块崟顖涘€甸悷娆忓缁€鍐煕閵婏箑顕滃ǎ鍥э躬閹虫粓妫冨☉姘辩嵁闂佽绻掗崑鐔煎疾椤愶箑围闁挎洖鍊归埛鎴︽偣閸ャ劌绲婚柛銈堜含缁辨挸顓奸崨顕呮&閻庤娲樺妯跨亙闂佸憡渚楅崢楣冨蓟瑜嶉埞鎴︽偐缂佹ɑ閿銈嗗灥濡繈骞冮敓鐘茬妞ゅ繐鎳庨弸鎴濃攽閻樿宸ラ柣妤€妫涚划鍫ュ醇閵夛妇鍘介梺鍝勫暙閸婂摜鏁崜浣虹<闁绘ê纾晶顒傜磼缂佹ḿ娲寸€规洖宕灒闁告繂瀚峰ḿ鏇犵磽閸屾瑨顔夋俊鐙欏洤纾婚柟鍓х帛閳锋帒霉閿濆牜娼愰柛瀣█閺屾稒鎯旈鑲╀桓閻庤娲樼换鍐箚閺冨牆惟闁靛鍎辨禍鍫曟⒒娴g儤鍤€濠⒀呮櫕閸掓帡顢涢悙鑼幈闂佺鎻梽鍕偂閺囩喓绠鹃柟瀵稿剳閸忣剟鏌涢弮鍌氭灁缂佽鲸甯¢幃鈺呮惞椤愩垻锛撻梻浣筋嚃閸犳銆冮崨杈剧稏婵犻潧顑嗛崑鍌炲箹缁顎嗛柟濂夊亰濮婄粯鎷呴搹骞库偓濠囨煛閸屾瑧绐旂€规洘鍨块獮姗€骞囨担鐟扮槣闂備線娼ч悧鍡椢涘Δ鍐當闁稿瞼鍋為悡鐔兼煙閾忕懓浠ч柣锝囨暩閳ь剝顫夊ú姗€宕濆▎鎾跺祦闁搞儺鍓﹂弫濠囨煟閻旂⒈鏆掑瑙勬礋閺岋綁鎮㈤崫銉﹀櫑闁诲孩鍑归崢鍓у垝閸儱鐒垫い鎺戝€荤壕浠嬫煕鐏炵偓鐨戠€涙繈姊洪幐搴㈠濞存粍绮撻、姘舵晲閸℃瑧鐦堝┑顔斤供閸撴瑩鎳撻崹顔规斀閹烘娊宕愰弴銏℃櫇闁靛牆顦粻鏍煙鏉堥箖妾柍閿嬪灩缁辨帡顢涘☉娆戭槬婵犫拃鍕弨闁哄矉缍侀幃銏ゅ级閹存繂袝闂備胶绮笟妤呭窗閺嶎剛浜欓梻浣告啞娓氭宕伴幒妤€绠繛宸簼閳锋垿鏌ゆ慨鎰偓鏇㈠几閹寸偟绡€闁靛繆妲勯懓鎸庮殽閻愭彃鏆f鐐差儔閺佸倿鎮剧仦钘夌闂傚倷鐒︾€笛呮崲閸屾粏濮冲┑鍌氭啞閻掕姤銇勯弽銊ヮ棜闁稿鎸鹃幉鎾礋椤掑偆妲伴梻浣告啞濮婂綊鎮烽敂鐣屸攳濠电姴娲ら柋鍥煛閸モ晛浠滅紒鎰洴濮婃椽宕橀崣澶嬪創闂佸摜鍠愭竟鍡欏垝閿濆憘鏃堝川椤旇瀚藉┑鐐舵彧缁蹭粙骞楀⿰鍛煋婵炲樊浜濋悡鏇㈡倵閿濆簼鎮嶉棅顒夊墰閳ь剝顫夊ú蹇涘垂閽樺鏆︽繝濠傛-濡茬偓绻涢幋鐐村碍缂佸顥愰悘鍐⒑閹稿海绠撻柟鍐查叄瀵娊鎮欓悜妯煎幗闂佽鍎抽悺銊х矆閸愵亞纾肩紓浣贯缚濞插鈧娲栧畷顒冪亙婵炶揪绲肩拃锕€煤閼哥數绡€缁剧増蓱椤﹪鏌涚€n偅宕屾慨濠佺矙瀹曠喖顢涘В纭风畵閺屾盯寮撮妸銉︾亾闂佹眹鍊愰崑鎾绘⒒娴g瓔娼愮€规洘锚閳绘柨鈽夐姀鐘靛幈婵犵數濮寸€氼喚澹曟禒瀣厱閻忕偟鍋撻惃鎴﹀冀閿熺姵鈷戠紓浣癸供濞堟洘銇勯妸銉уⅵ妤犵偞鍨挎慨鈧柣姗嗗亝閺傗偓闂佽鍑界紞鍡涘磻閹烘嚦娑㈠礃閵娿垺鏂€闂佺粯鍔栧ḿ娆撴倶閵壯€鍋撶憴鍕闁告挾鍠庨悾宄扳堪閸曨偒鍤ら柣搴㈢⊕宀e潡宕㈤棃娑辨富闁靛牆妫涙晶顒傜磼椤旇偐鐒哥€殿喚枪閳藉鈻庨幇顒€浼庡┑鐘垫暩婵挳骞婅箛娑辨晜闁绘ḿ绮悡鍐喐濠婂牆绀堟繛鍡楅獜閼板潡寮堕崼娑樺闁告瑥绻橀弻锝夊閳跺墎顢婄换姘舵⒒娴e憡鍟為柛鏃撶畵瀹曟澘螖閸涱喖浜楅梺缁樶缚缁垶鎮¢弴銏$厵闂侇叏绠戦悘鐘绘煟閵婏附銇濋柡灞剧洴閸╋紕鈧綆鍓涜摫闂備線娼уú銈団偓姘卞閹便劑鍩€椤掑嫭鐓ユ繛鎴灻顏堟煕閿濆嫬宓嗛柟顔筋殘閹叉挳宕熼鍌ゆК闁诲氦顫夊ú锕傚礈閻旂厧鏄ラ柕澶涚畱缁剁偛鈹戦悙闈涗壕闁诲骸顭烽弻锝堢疀閺囩偘娌梺绋垮婵炲﹪銆侀弮鍫濇嵍妞ゆ挾濮烽敍婵嬫⒑缁嬫寧婀伴柤褰掔畺閸┾偓妞ゆ帊鐒﹂崐鎰偓瑙勬礃閸旀瑩骞冨⿰鍫熷殟闁靛鍎崑鎾诲锤濡や胶鍙嗛梺鍝勬川閸嬫盯鍩€椤掍胶鎽冪紒缁樺哺濮婄粯鎷呴崨濠呯闂佺ǹ绨洪崐鏇犲弲闂婎偄娲﹀濠氥€呴懠顒佸枑闁绘鐗嗙粭姘舵煟閹惧鎳囬柡宀嬬秮楠炲鎮欓妸褏绐楃紓鍌欒兌婵敻鎮ч悩璇茶摕闁跨喓濮村钘壝归敐鍥у幋闁稿顨婂铏规嫚閳ヨ櫕鐏堥梺鎼炲灪閻擄繝濡堕鍛嚤闁哄鍨归ˇ銊ヮ渻閵堝懐绠版俊顐弮瀹曨剙煤椤忓應鎷绘繛杈剧到閹诧繝宕悙鐑樺仺妞ゆ牗渚楀▓姗€鏌℃笟鍥ф灈閾绘牠鏌涢幇銊︽珔閹兼潙锕ら埞鎴︽偐缂佹ɑ閿┑鈽嗗亽閸樼厧鐜婚崸妤€鐓涢柛灞久肩花濠氭⒑鐟欏嫬绀冩繛澶嬬⊕缁傛帡骞掗弮鍌滐紳闂佺ǹ鏈粙鎺戠暦鐏炵偓鍙忓┑鐘插鐢盯鏌熷畡鐗堝殗鐎规洏鍔嶇换婵嬪磼濞戞瑧鏆紓鍌氬€搁崐椋庣矆娓氣偓椤㈡牠宕卞☉妯虹€梺绉嗗嫷娈旈柡瀣╃窔閺屾盯骞囬棃娑欑亶闂佸搫鎳忕换鍫ュ蓟濞戞矮娌柟瑙勫姇椤ユ繈姊虹粙娆惧剰缂佸鎳撻~蹇涘传閸曟嚪鍥х倞鐟滃繑绂掓總鍛娾拺缁绢厼鎷嬮崵瀣磼缂佹ḿ绠炵€规洖鎼埥澶愬閻樻鍚呴梻浣虹帛宀e潡寮幖浣规櫖婵犻潧娲ㄧ粻楣冨级閸繂鈷旈柛鎺斿閵囧嫰顢曢敐鍥р拰濡炪們鍨哄Λ鍐ㄧ暦婵傚憡鍋勯悘蹇庣娴滈箖鏌涢锝嗙闁绘挶鍎甸弻锟犲炊閳轰椒绮堕梺閫炲苯澧繝鈧柆宥呯劦妞ゆ帊娴囨竟姗€鏌熼搹顐€顏堬綖韫囨拋娲敂瀹ュ棙娅岄梻渚€鈧偛鑻晶鎵磼椤旇姤顥堥柟顔荤矙瀹曘劍绻濋崒娆戞殫闂傚倷鑳剁划顖炲蓟閵娾晛瑙﹂悗锝庡枟閸嬪倹绻涢崱妯诲鞍闁绘挻娲橀妵鍕敇閻旈浠撮梺鍝勵儐缁嬫帡濡甸崟顔剧杸闁挎繂鎳嶇花鐣岀磽娴d粙鍝洪悽顖涱殔椤曘儵宕熼瀣枛閹粌螣閻撳海绉甸梻鍌氬€风粈渚€骞栭锝呯窞闁搞儺鍓欓悞鍨亜閹哄棗浜剧紒鍓ц檸閸欏啫顕i幎钘夊耿婵炴垶鐟ч崢鎾绘偡濠婂嫮鐭掔€规洘绮撻幃銏☆槹鎼淬垺顔曞┑鐐存綑閸氬岣垮▎鎾崇闁逞屽墮椤啴濡堕崱妯洪瀺婵犮垼顫夊ú鐔风暦閹达箑绠婚悗娑櫭鎾绘⒑閸涘﹥灏€殿喖鐖煎畷鎾绘偨閸涘﹦鍘介梺缁樏鍫曞箚閸儲鐓欑痪鏉垮船娴滀即鏌熼搹顐e磳鐎规洖缍婇、娆戞喆閸曨剚婢戦梻鍌欒兌缁垶宕濋弴鐑嗗殨闁割偅娉欐径鎰€烽柣鎴炨缚閸橀亶姊洪棃娑氬闁稿﹦鎳撻埢宥夊川椤曞懏顔囧銈呯箰閸燁偄鐣甸崱娆屽亾鐟欏嫭绀冮柨鏇樺灲瀵偊骞囬弶鍨€垮┑鈽嗗灣缁垳娆㈤锝囩瘈缁炬澘顦辩壕鍧楁煕鐎n偄鐏寸€规洘鍔欏鍊燁檨婵炲吋鐗曢埞鎴︽偐鐎圭姴顥濋弶鈺傜箞閺岋絾鎯旈婊呅f繛瀛樼矊閻栫厧鐣烽鐐插窛閻庢稒岣块崢顏呯節閵忥絽鐓愮紒瀣墱缁牏鈧綆鈧垻鎳撻オ浼村礋椤撶姷鍘戦梻渚€娼уú銈団偓姘嵆閻涱喖螣閸忕厧纾柡澶屽仦婢瑰棝骞戦弴鐔虹瘈缁剧増锚婢ц尙鎲搁弶鍨殻闁炽儻绠撻幃婊堟寠婢跺孩鎲伴梻浣瑰缁诲倿藝娴兼潙鐤鹃柡灞诲劜閻撴洟鏌曟径瀣仴闁哥噥鍋嗙划濠氭晲閸℃洜绠氶梺闈涚墕濞层倕鏆╅梻浣呵归鍥磻閻旂厧鏋佹い鏇楀亾闁轰焦鎹囬幃鈺呮濞戞哎鍋婇梻浣筋嚙閸戠晫绱為崱娑橀棷妞ゆ洍鍋撶€殿噮鍋婂畷鍫曨敆娴e搫骞楅梻浣告惈閸婃悂鎮樺┑鍠絾绻濆顓犲幈濠碘槅鍨抽崢褎绂掑⿰鍫熺厓閻熸瑥瀚悘鎾煛娴e摜效鐎规洜鍠栭、鏇㈠焺閸愨晝绐旈梻鍌氬€烽懗鑸电仚闂佹寧娲忛崕鐢稿箖瑜旈幃鈺呮嚑椤掍焦顔曢柣鐔哥矌婢ф鏁Δ鍛;闁稿本渚楀▓浠嬫煟閹存繃顥滃褜鍨堕弻锝夊煛婵犲倻浠╅梺浼欑悼閸忔﹢骞冮姀銏犳瀳閺夊牄鍔嶅▍宀勬⒒娴e懙鍦偖椤愶箑纾归柡宥庡幗閻撱儵鏌曢崼婵囧櫝闁衡偓娴犲绠抽柟鎯版绾惧湱鎲歌箛鎿冨殫濠电姴鍟伴々鐑芥倵閿濆簼绨介柡灞界墕椤啴濡堕崱娆忊拡闂佺ǹ顑囬崑銈呯暦閹达箑纾奸柣鎰嚟閸樻悂姊洪幖鐐插姉闁哄懏鐩鎼佸籍閸屾粎锛滈梺鎶芥暜閸嬫捇鏌涚€n偅宕屾慨濠傤煼瀹曟帒顫濋钘変壕闁归棿鐒﹂崑瀣攽閻樻彃顏柣顓熺懇閺岀喐娼忛幆褏妲i梺杞扮閸婂潡寮诲澶婁紶闁告洦鍓欏▍銈夋⒑缂佹ɑ灏版繛鑼枛瀵鏁撻悩鑼槰闂佹寧绻傞幊宥嗙珶閺囩喍绻嗛柣鎰典簻閳ь剚鍨垮畷婵嗙暆閸曨剚娅囧銈呯箰鐎氱兘宕甸弴銏″仯闁搞儯鍔庨妶瀛樹繆閹绘帞澧涢柟渚垮妼椤粓宕奸姀鐘茬厒濠电偛鐡ㄧ划鎾剁不閺嶎厼钃熼柕濞垮劗閺€浠嬫煕閳╁啩绶遍柍褜鍓氶〃鍛存箒濠电姴锕ょ€氼喚绮婚悙鐑樼厵妞ゆ棁顫楅崷顓犱笉婵炴垯鍨洪弲鏌ユ煕濞戝崬骞樻い鏃€鍨垮缁樼瑹閳ь剙岣胯鐓ら柕鍫濇礌閸嬫挸顫濋銏犵ギ闂侀潧妫旂欢姘嚕閹绢喖顫呴柍鈺佸暞閻濇娊姊绘担瑙勫仩闁稿寒鍣e鎻掆攽鐎n亞楠囬梺鑺ッˇ顐﹀绩娴犲鐓熸俊顖涙た閸熷繘鏌¢崱妯肩煂缂佽鲸甯楀ḿ蹇涘Ω閿旂虎妲归柣搴ゎ潐濞叉﹢銆冮崨鎵航闂佽崵濮崇粈浣哄椤撶姷涓嶆慨妯垮煐閳锋垹绱撴担濮戭亪鎮樻潏銊ょ箚妞ゆ劑鍨归鈺呮煛娓氬洤鏋熷ǎ鍥э躬閹瑩顢旈崟銊ヤ壕闁哄诞灞剧稁婵犵數濮甸懝楣冩偪閻愵兙浜滈柟鎵虫櫅閳ь剚顨婇幆宀勫箻缂佹ḿ鍘介梺闈涚箳婵敻宕悙鐑樼厓闂佸灝顑呯粭鎺楁婢舵劖鐓ユ繝闈涙瀹告繈鏌熼挊澶娾偓鍧楀蓟濞戙垹围闁糕剝鐟﹂崳顓㈡⒑闁稓鈹掗柛鏂跨焸閿濈偛饪伴崼婵嬪敹闂侀潧绻堥崹鍝勨枔婵傚憡鈷掑ù锝囨嚀椤曟粎绱掔拠鎻掝伃鐎规洘鍨块幃娆忣啅椤斿吋顔傞梻浣告啞濞诧箓宕滃☉姘变笉濡わ絽鍟悡娆撴煟閹寸伝顏堟倶閿曞倹鐓欐い鏍ㄦ皑婢ф盯鏌曢崶褍顏い銏℃礋閺佹劙宕堕埡鍐ㄥ辅闂傚倷鑳剁涵鍫曞棘娓氣偓瀹曟垿骞橀幇浣瑰瘜闂侀潧鐗嗗Λ妤呭锤婵犲洦鐓曢悗锝庡亝瀹曞矂鏌″畝瀣М闁轰焦鍔欏畷銊╊敇閻旀壕鏅犲铏光偓鍦濞兼劙鏌涢妸銉т虎闁伙綁鏀卞ḿ蹇涱敃閵堝洦婢戦梻浣告惈閸燁偊宕愰悽绋跨;闁规儳顕弧鈧┑顔斤供閸樻悂骞忓ú顏呯厽闁绘柨鎽滈幊鍐倵濮樼厧澧扮紒顔肩墦瀹曟﹢鍩¢崘顏嶅晭濠电姰鍨煎▔娑㈩敄閸ヮ剙违闁圭儤姊荤壕鍏笺亜閺冨倶鈧鐓鍕厸濞达絿枪閺嗭絿鈧娲樼敮鎺楀煡婢跺⿴娼╂い鎺嗗亾缂佺姵妞藉缁樻媴閻戞ê娈岄梺鍛婅壘椤戝鐛崱妤冩殕闁告洦鍋勯悗顓㈡倵鐟欏嫭绀€婵炲眰鍔戦幆宀勫箻缂佹ḿ鍘介梺闈涚箳婵敻宕悙鐑樼厽闁规儳鐡ㄧ粈瀣煛瀹€瀣埌閾伙綁鎮归崶銊ョ祷妞ゎ偒浜滈埞鎴︽倷閼碱剙顤€缂備緡鍠栭柊锝夊春閳ь剚銇勯幒宥囪窗闁哥喎绻橀弻娑㈡偐閹颁焦鐣介梺闈涙处閸旀瑥鐣峰鈧、娆撴嚃閳轰礁绠i梻鍌欒兌閹虫捇顢氶鐔稿弿妞ゆ挶鍨圭壕濠氭煙閸撗呭笡闁哄懏鐓¢獮鏍垝閸忓浜鹃柤纰卞墯閺呭ジ姊婚崒娆戭槮闁圭寽銈嗘噷闂備礁婀遍幊鎾趁洪銏㈠祦闁告劑鍔庨弳瀣煙闂堟稑鏆遍柣妤佸哺濮婃椽宕ㄦ繝鍐槱闂佸憡锕㈢粻鏍箖閳╁啫绶為柟閭﹀幖閳ь剛鏁婚幃宄扳枎韫囨搩浠剧紓浣插亾闁告劦浜炵壕鍏笺亜閺冨洤袚鐎规洖鏈〃銉╂倷閹绘帗娈绘繝娈垮枓閸嬫捇姊洪棃娑氬婵☆偅顨嗙粋宥呂旈崨顔惧幍闂佺厧婀辨晶妤勩亹瑜忕槐鎺楀箵閹烘挸浠撮悗娈垮枟婵炲﹪銆侀弴銏℃櫆閻熸瑱绲剧€氳棄鈹戦悙鑸靛涧缂傚秮鍋撳┑鐐叉嫅缁插潡寮灏栨闁靛骏绱曢崢閬嶆⒑閸濆嫬鏆婇柛瀣尰缁绘盯鎳犻鈧弸娑㈡煟濞戝崬娅嶇€殿喕绮欓、妯款槼闁哄懏绻堝娲箰鎼淬垻锛曢梺绋款儐閹瑰洭寮诲☉銏犖╅柕澶堝劗閸嬫捇宕稿Δ鈧拑鐔哥箾閹寸偟鐓繛宀婁邯閺屾盯骞樺璇蹭壕濠碘槅鍋侀崝宥囨崲濞戞埃鍋撳☉娆嬬細闁活厼顑囩槐鎺楊敊閼恒儱纾抽悗娈垮枛椤兘骞冮姀銈呯闁兼祴鏅涙慨娲⒒娴g懓顕滄繛鎻掔Ч瀹曟垿骞樼紒妯煎幐闁诲函缍嗛崑鍡涘Υ閹烘嚚鐟扳堪閸曨厽鎲欑紓浣哄У閻╊垰顕i幘顔藉亹缁炬澘顦遍梻顖涚節閻㈤潧浠╅柟娲讳簽缁辩偞鎷呯紘鏃傜窗閻熸粌瀛╃粚杈ㄧ節閸パ咁槯缂備焦顨夊銊ц姳鐠囧樊娓婚柕鍫濇鐏忕敻鏌涚€n偆鈽夐崡杈╃磽娴i婊勭濠婂嫨浜滈柟鎵虫櫅閻忣喚绱掗悩鍗炲祮闁诡噯绻濇俊鍫曞幢閹邦亞鐩庨梻濠庡亜濞诧箓骞愰幖渚囨晜妞ゅ繐妫岄崑鎾舵喆閸曨剙纰嶇紓浣割槹閹告娊鍨鹃弮鍫濈妞ゆ柨妲堣閺屾盯鍩勯崗鐙€浜鍐参旈崨顔规嫼缂備礁顑嗛娆撳磿閹邦喚纾奸悗锝庡亜缁楁氨绱掑畝鍐摵缂佺粯绻堝畷鎴︻敍濞戞瑣浠㈠銈冨灪濡啫鐣烽妸鈺婃晜闁告侗鍙庢导鏍磽閸屾艾鈧悂宕愭搴㈩偨闁跨喓濮撮崹鍌炴煕濡ゅ啩绱抽柛婵嗗珋閻旂儤鍋橀柍鈺佸暟閳ь剚妞藉娲川婵犲嫧妲堥梺瀹︽澘濮傞柟顕嗙節婵$兘鍩¢崒婊冨箰闂備焦鎮堕崕顖炲磿鏉堛劋绻嗛柧蹇撴贡绾惧ジ鏌曟繛褍鎳庣粭锟犳⒑闂堟稒鎼愰悗姘緲椤曪綁骞橀鍛櫆闂佺硶鍓濋宄扳堪閸曨厾鐦堢紒鍓у閿氬褎鐓¢弻鐔碱敊閻撳簶鍋撻崹顕呭殨妞ゆ劧绠戠壕濂告煟閹邦垰鐨烘い锔诲弮閹嘲饪伴崘顏嗩唶闁告浜堕弻娑㈠Ψ閿濆懎顬嬬紓浣叉閸嬫挻绻濋悽闈涗粶闁绘妫濋幃妯衡攽鐎n亜鍤戦梺缁樻煥閸氬鎮¢妷鈺傜厸闁搞儺鐓堝▓鏇熺箾閸涱叏鍔熼柍褜鍓濋~澶娒鸿箛娑樺瀭闁惧繐婀辩槐锕傛煟閿濆懐鐏遍柣顓熺懇閹綊骞侀幒鎴濐瀳婵犳鍣梽鍕┍婵犲洦鍊锋い蹇撳閸嬫捇寮借閸熷懎鈹戦悩瀹犲缁炬儳顭烽弻鐔煎礈瑜忕敮娑㈡煟閹捐泛鏋涢柣鎿冨亰瀹曞爼濡搁敂鎯у汲闂備礁鎲$换鍕磿閵堝鈧啴濡烽埡鍌氣偓鐑芥煠绾板崬澧柍顏勭仛缁绘繄鍠婂Ο鍝勨拤闂佽鍠栭崐瑙勭┍婵犲洦鐓ラ悗锝庡亜閸斿懘姊洪幐搴g畵闁瑰啿绻橀幃姗€宕奸妷锔规嫼闁荤姴娲犻埀顒冩珪閻忊偓闂備礁鎲¢幐鑽ゆ崲閸儳宓侀柛鈩冪☉濡﹢骞栫€涙ɑ灏伴柡鍌楀亾闂傚倷鑳剁涵璺侯瀶瑜斿鎻掆堪閸╄泛顦甸弫鎾绘偐閺傘儲瀚介梻浣呵归張顒勬偡閿斿墽鐭堥柣妤€鐗勬禍婊堟煛閸パ勵棞闁瑰啿顦靛畷鎴﹀箻閺傘儲顫嶉梺鍦劋閹稿鎮靛鑸碘拺閻犲洠鈧櫕鐏侀梺鎼炲妺缁瑩濡存担鑲濇棃宕ㄩ鐙€妲规俊鐐€栭崝鎴﹀磹閵堝鑸归柣銏犳啞閳锋帒霉閿濆牆袚缁绢厼鐖奸弻娑㈡晲韫囨洜鏆ゅΔ鐘靛仜缁绘﹢寮幘缁樻櫢闁跨噦鎷�






