氧化铜自身具有氧化性,我们可以用一氧化碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
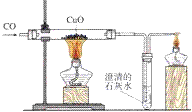
一氧化碳还原氧化铜的实验:
1. 实验器材
铁架台、酒精灯(也可以是酒精喷灯)、试管、导管、双孔橡皮塞、单孔橡皮塞。 药品有:氧化铜、澄清石灰水、一氧化碳
2. 化学反应
CO与CuO反应的化学方程式为: CO+ 2CuO
 2Cu + CO2
2Cu + CO2 CO2与Ca(OH)2(澄清石灰水)反应的化学方程式: Ca(OH)2+CO2=CaCO3↓+H2O
3. 反应现象
①黑色固体变成红色②导管口有气泡冒出③澄清石灰水变浑浊
4. 实验步骤
(1)连接装置
(2)检查装置的气密性。
(3)点燃加热尾气的酒精灯。
(4)通入CO,排除串联装置中的空气。
(5)加热CuO。
(6)停止加热CuO。
(7)通入CO,排净残留在串联装置中的空气。
(8)停止点燃尾气。
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽,加热时发生爆炸。
②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜、防止澄清石灰水倒流。
总之:"CO早出晚归,酒精灯迟到早退",也说“先通后点防爆炸,先熄后停防氧化。”
③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气,使人中毒。
注:此试验应在通风橱中进行:防止没除净的CO使人中毒。
5. 装置:
相关初中化学知识点:氢气还原氧化铜
氧化铜自身具有氧化性,我们可以用氢气还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
氢气还原氧化铜实验:
| 原理 | H2+CuO H2O+Cu H2O+Cu |
| 装置 |  |
| 步骤 | ①先通氢气(直到盛氧化铜的试管内充满纯净的氢气) ②后点燃洒精灯加热 ③先熄灭洒精灯停止加热(当出现明显的实验现象后) ④后停止通氢气(等试管冷却后再停止) 简单记忆为“氢气早来晚走,酒精灯迟到早退” |
| 现象 | ①黑色氧化铜变成光亮红色 ②试管口处有小水珠 |
| 注意事项 | ①通氢气的导管必须伸入试管底部,保证与氧化铜充分反应 ②必须先通氢气后加热,否则可能会发生爆炸 ③停止加热后必须等试竹冷却后再停止通氢气,否则铜可能会重新被氧化 |
实验总结顺口溜:
氢气验纯试管倾
先通氢气后点灯
黑色变红水珠出
熄灭灯后再停氢
相关初中化学知识点:木炭还原氧化铜
氧化铜自身具有氧化性,我们可以用碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
木炭还原氧化铜实验:
1.原理:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
2.装置:
3.现象:
①黑色粉末变成红色;
②澄清石灰水变浑浊
4.步骤:①装药品;②固定试管,连接装置;③加热;④撤出导管;⑤熄灭酒精灯
5.注意:
①要先撤导管再扯酒精灯,防止水倒吸。
②要充分加热木炭和氧化铜粉末,除去其中水分。
③研磨混合要充分。
④加热温度要足够,最好使用酒精喷灯或煤气灯
本文来自:逍遥右脑记忆 http://www.jiyifa.net/chuzhong/282550.html
相关阅读:初中化学学习方法漫谈



