金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
| 物理性质 | 物理性质比较 |
| 导电性 |  |
| 密度 |  |
| 熔点 |  |
| 硬度 |  |
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
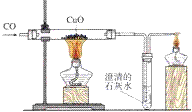
相关初中化学知识点:一氧化碳还原氧化铜
氧化铜自身具有氧化性,我们可以用一氧化碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
一氧化碳还原氧化铜的实验:
1. 实验器材
铁架台、酒精灯(也可以是酒精喷灯)、试管、导管、双孔橡皮塞、单孔橡皮塞。 药品有:氧化铜、澄清石灰水、一氧化碳
2. 化学反应
CO与CuO反应的化学方程式为: CO+ 2CuO
 2Cu + CO2
2Cu + CO2 CO2与Ca(OH)2(澄清石灰水)反应的化学方程式: Ca(OH)2+CO2=CaCO3↓+H2O
3. 反应现象
①黑色固体变成红色②导管口有气泡冒出③澄清石灰水变浑浊
4. 实验步骤
(1)连接装置
(2)检查装置的气密性。
(3)点燃加热尾气的酒精灯。
(4)通入CO,排除串联装置中的空气。
(5)加热CuO。
(6)停止加热CuO。
(7)通入CO,排净残留在串联装置中的空气。
(8)停止点燃尾气。
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽,加热时发生爆炸。
②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜、防止澄清石灰水倒流。
总之:"CO早出晚归,酒精灯迟到早退",也说“先通后点防爆炸,先熄后停防氧化。”
③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气,使人中毒。
注:此试验应在通风橱中进行:防止没除净的CO使人中毒。
5. 装置:
相关初中化学知识点:金属的化学性质
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 | 点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 | 2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 | 点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 | 4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 | 3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 | 加热,生成黑色固体 | 2Cu+O2 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | ?? | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu | 锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag | 无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu | 铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag | 无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag | 无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
相关初中化学知识点:金属的回收利用
定义:
金属回收是指从废旧金属中分离出来的有用物质经过物理或机械加工成为再生利用的制品。是从回收、拆解、到再生利用的一条产业链。
保护金属资源的途径:
(1)回收利用废旧金属;
(2)防止金属制品锈蚀;
(3)合理地、有计划地开采金属矿物;
(4)寻找替代品。
废旧金属的回收利用的优点:
(1)废旧金属的回收利用可以节约金属资源和能源。
(2)废旧金属的回收还可以保护环境,减少对环境的污染。
本文来自:逍遥右脑记忆 http://www.jiyifa.net/chuzhong/284721.html
相关阅读:五点可以让你学好初中化学
鐗堟潈澹版槑锛氭湰鏂囧唴瀹圭敱浜掕仈缃戠敤鎴疯嚜鍙戣础鐚紝璇ユ枃瑙傜偣浠呬唬琛ㄤ綔鑰呮湰浜恒€傛湰绔欎粎鎻愪緵淇℃伅瀛樺偍绌洪棿鏈嶅姟锛屼笉鎷ユ湁鎵€鏈夋潈锛屼笉鎵挎媴鐩稿叧娉曞緥璐d换銆傚鍙戠幇鏈珯鏈夋秹瀚屾妱琚镜鏉�/杩濇硶杩濊鐨勫唴瀹癸紝璇峰彂閫侀偖浠惰嚦 4509422@qq.com 涓炬姤锛屼竴缁忔煡瀹烇紝鏈珯灏嗙珛鍒诲垹闄ゃ€�






