是指物质得电子的能力。处于高价态的物质一般具有氧化性。
还原性:
是指物质失电子的能力,一般低价态的物质具有还原性。
氧化性,还原性强弱的比较方法:
(1)根据氧化还原反应方程式判断
氧化性:氧化剂的氧化性>氧化产物的氧化性
还原性:还原剂的还原性>还原产物的还原性
(2)根据金属(非金属)活动性顺序判断
①金属活动性顺序
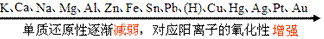
②非金属活动性顺序
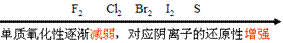
(3)根据与同一物质反应的难易(条件)判断:
当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件高低来进行判断。
例:
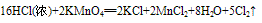
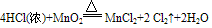
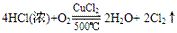
三个反应还原剂都是浓盐酸,氧化产物都是氯气,氧化剂分别是高锰酸钾、二氧化锰、氧气,有反应方程式可得,反应条件越来越难,可得结论:氧化性KMnO4> MnO2> O2
(4)根据氧化产物的价态高低判断
当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态高低来判断氧化剂氧化性的强弱。
例如:
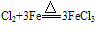 ,
,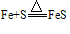 ,可得:氧化性Cl2>S
,可得:氧化性Cl2>S注:不能通过氧化剂化合价降低的多少来判断氧化性的强弱。
(5)根据元素周期表判断
①同周期主族元素从左→右,金属单质还原性逐渐减弱(对应的阳离子的氧化性逐渐增强),非金属单质氧化性逐渐增强(对应的阴离子的还原性逐渐减弱);
同主族元素从上→下,金属单质还原性逐渐增强(对应的阳离子的氧化性逐渐减弱),非金属单质氧化性逐渐减弱(对应的阴离子的还原性逐渐增强)。
注:元素在周期表中越是位于左下方,其单质的还原性越强,其阳离子的氧化性越弱;元素在周期表中越是位于右上方,其单质的氧化性越强,其阴离子的还原性越弱。
(6)根据原电池、电解池的电极反应判断氧化性、还原性的强弱 (根据这个规律也可判断原电池、电解池电极)
①两种不同金属构成原电池的两级:负极:金属电子流出,正极:金属电子流入
还原性:负极>正极
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
(7)根据物质浓度的大小比较:
具有氧化性(或还原性)的物质的浓度越大,其氧化性(还原性)越强,反之,其氧化性(还原性)越弱。例如:氧化性HNO3(浓)>HNO3(稀);还原性 HCl(浓)>HCl(稀)
(8)根据氧化剂、还原剂性质的影响因素判断
①温度:一般温度高氧化剂的氧化性强(浓H2SO4与Cu常温不反应,加热则反应)。
②酸碱性:一般在酸性条件下氧化剂的氧化性增强。如KMnO4在酸性条件下氧化能力更强;KClO3能氧化浓盐酸中的Cl- → Cl2,而不能氧化NaCl中的Cl-;又如在中性溶液中Fe2+与NO3-可共存但在H+存在的条件下Fe2+与NO3-不共存等。
知识扩展:
一般来说,同种元素形成的物质,元素价态越高,氧化性越强。例如:氧化性 KMnO4>MnO2,但是,也不完全按这个规律,比如 HClO>HClO2>HClO3>HClO4,再有HNO2>HNO3 。这是因为:氧化性的强弱是看物质得失电子的难易程度,容易失电子的物质还原性强,容易得电子的物质氧化性强。次氯酸很不稳定,容易分解,得到盐酸和氧气(2HClO==2HCl+O2),由此可知,次氯酸中氯元素很容易得电子,则氧化性强。亚硝酸只能存在于很稀的冷溶液中,溶液浓缩或加热时,很容易就分解成H2O和N2O3,故HNO2的氧化性更强。
相关高中化学知识点:物质的推断
概念:
物质的推断就是运用物质的特殊性质和特征反应.根据实验现象得出正确的结论。同一推断题可能存在多个突破点,可以从不同角度或不同种方法寻找解题突破口,同叫检验推断结果,保证答案的准确性。推断题题型具备考查知识面广、综合性强、题型多变、思维容量大等特点。要解好此类题口,要求大家要有扎实的元素化合物的基础知识和实验技能,还必须具备科学、严密的思维方法和良好的分析问题、解决问题的能力。
常见物质的颜色:
多数气体为无色,多数固体化合物为白色,多数溶液为无色。
黑色固体:MnO2、CuO、Fe3O4、C粉、铁粉(Fe)活性炭
蓝色固体:CuSO4·5H2O(胆矾)、Cu(OH)2(氢氧化铜)、CuCO3(碳酸铜)
红色固体:Cu(紫红色)、Fe2O3(红棕色)、红磷:P(暗红色)、Fe(OH)3(红褐色)I2碘(紫红色)
黄色固体:硫磺(单质S)
绿色固体:碱式碳酸铜(铜绿)[Cu2(OH)2CO3]
蓝色溶液:含Cu2+溶液:CuSO4(硫酸铜溶液)、CuCl2(氯化铜溶液)Cu(NO3)2(硝酸铜溶液)
黄色溶液:含Fe3+的溶液(棕黄色):FeCl3(氯化铁溶液)、Fe2(SO4)3(硫酸铁溶液)Fe(NO3)3(硝酸铁溶液)
浅绿色溶液:含Fe2+的溶液:FeCl2(氯化亚铁)FeSO4(硫酸亚铁)Fe(NO3)2(硝酸亚铁)
其他溶液:石蕊试液(紫色)、高锰酸钾溶液(紫红色)
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润的红色石蕊试纸变蓝色)、SO2、HCl(氯化氢)
有臭鸡蛋气味:H2S硫化氢
气体的特征:
①有刺激性气味的气体:HCl、SO2、NH3
②有颜色的气体:Cl2(黄绿色)、NO2(红棕色)
③无色无味的气体:O2、H2、N2、CO、CO2。
特征反应:
| 特征反应 | 常见反应 |
| 在催化剂作用下发生的反应 | 双氧水或氯酸钾分解 |
| 通电发生的反应 | 电解水 |
| 产生大量白烟的燃烧 | 磷燃烧 |
| 发出耀眼白光的燃烧 | 镁带在空气中燃烧,铝箔在O2中燃烧 |
| 产生明亮蓝紫色火焰并生成有刺激性气味气体的燃烧 | 硫在氧气中燃烧 |
| 产生淡蓝色火焰且罩在火焰上方的小烧杯内壁有水珠出现 | 氢气在空气中燃烧 |
| 产生蓝色火焰的燃烧 | CO和CH4在空气中燃烧 |
| 有火星四射的燃烧 | 铁在氧气中燃烧 |
| 生成蓝色沉淀的反应 | 可溶性碱+可溶性铜盐 |
| 生成红褐色沉淀的反应 | 可溶性碱+可溶性铁盐 |
| 溶液加酸放出CO2气体 | 碳酸盐(或碳酸氢盐)+酸 |
| 固体加酸放出气体 | 氢前金属或碳酸盐+酸 |
推断题的解题步骤及突破口的选择:
1.解题步骤
(1)审题:认真审读原题,弄清文意和图意,理出题给条件,深挖细找.反复推敲。
(2)分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质的特征等等.然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果,
(3)解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
(4)检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
2.突破口的选择
(1)颜色特征:根据物质的特殊颜色进行判断。包括常见固体、沉淀、溶液、火焰的颜色。
(2)反应特征
(3)物质状态特征
常见固体单质:Fe、Cu、C,S,P;气体单质:H2、O2、 N2;气体化合物:CO、CO2、CH4、SO2;常温下呈液态的物质:H2O、H2O2、酒精、H2SO4.
(4)反应条件特征
点燃:有O2参加的反应;通电:H2O的电解;MnO2 作催化剂:KClO3分解制O2、H2O2分解制O2;高温: CaCO3分解、C还原CuO、炼铁;加热:KClO3、KMnO4、 Cu2(OH)2CO3的受热分解。
(5)以三角关系为突破口

(6)以物质特征现象为突破口
①能使澄清石灰水变浑浊的无色无味气体是CO2。
②能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,同体是C。
③能使燃烧着的小条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2.
④能使白色无水CuSO4。粉末变蓝的气体是水蒸气。
⑤在O2中燃烧火星四射的物质是Fe。
⑥在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑦能溶于盐酸或稀HNO3的白色沉淀有CaCO3、 BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
(7)以元素或物质之最为突破口 ①地壳中含量最多的元素是O,含量最多的金属元素是Al。
②人体中含量最多的元素是O2。
③空气中含量最多的元素是N。
④形成化合物最多的元素是C。
⑤质子数最少的元素是H。
⑥相对分子质量最小、密度也最小的气体是H2.
⑦相对分子质量最小的氧化物是H2。
⑧自然界中硬度最大的物质是金刚石。
⑨空气中含量最多的气体是N2。
⑩最简单的有机物是CH4。
 最常用的溶剂是H2O。
最常用的溶剂是H2O。  人体中含量最多的物质是H2O。
人体中含量最多的物质是H2O。(8)以特定的实验结果为突破口
| 实验结果 | 可能情况分析 |
| 固体混合物加水后出现不溶物 | a.源混合物中有不溶物.如CaCO、、 Al(OH)3等 b.混合物中物质反应生成沉淀,如 Na2SO4和BaCl2、Na2CO3和Ca(OH)2等 |
| 向固体混合物中加水得到无色溶液 | 混合物中一定不含含Fe2+、Fe3+ 、Cu2+、MnO4- |
| 生成有色沉淀 | a.生成红褐色Fe(OH)3,是Fe3+的盐与碱溶液反应,如FeCl3+3NaOH== Fe(OH)3↓+3NaCl b.生成蓝色沉淀.是Cu2+的盐与碱溶液反应,如2NaOH+CuSO4==Cu(OH)2↓ +Na2SO4 |
| 常见沉淀的性质 ①既不溶于水义不溶于酸 ②能溶于酸但不生成气体 ③能溶于酸且生成气体 ④加足量酸沉淀部分溶解 | ①如BaSO4和AgCl ②不溶的碱,如Mg(OH)2 ③不溶的碳酸盐,如CaCO3 ④沉淀为混合物,既含BaSO4或AgCl中的至少一种,又含有CaCO3、Mg(OH)2等不溶物 |
本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/264846.html
相关阅读:孩子的人生,让孩子自己去走



