二氧化氯:
二氧化氯有与氯气相似的刺激性气味,具有强烈刺激性,接触后主要引起眼和呼吸道刺激,吸入高浓度可发生肺水肿,能致死,对呼吸道产生严重损伤,高浓度的本品气体,可能对皮肤有刺激性。皮肤接触或摄入本品的高浓度溶液,可能引起强烈刺激和腐蚀,长期接触可导致慢性支气管炎。
二氧化氯的物理性质和化学性质:
(1)物理性质:二氧化氯(ClO2)是一种棕红色气体,浓度低是黄绿色气体,相对空气比重为1.1,比空气重,液体比重2.37,具有与氯相似的刺激性气味,浓度极低时,具有青草气味及轻微的甜味,沸点11℃凝固点-59℃,易溶于水和冰醋酸、四氯化碳等溶剂,液化二氧化氯及高浓度二氧化氯极不稳定,撞击或日光照射均会发生爆炸,在空气中,浓度超过10%就可能发生爆炸,低于10%则是稳定性极好的物质,没有爆炸的危险。
(2)化学性质:二氧化氯易溶于水,深解度是氯气的5倍,在室温30mm/Hg分压下,溶解度为2.9g/L;在室温760mm/Hg压力(常压),溶解度为3.1g/L,二氧化氯不易被水解,在水中以分子的形成存在,在低浓度下,(10mg/L以下)它杀茵、消毒能力,主要以氧化的方式进行,与氯气杀茵消毒不同,氯气消毒以电子转移的方式进行,因此ClO2杀茵可在pH值较大范围内(2-10)高效杀菌消毒,且对人体绝无害处,经检测水中ClO2在1mg/L浓度以下时对比1mg/L氯气的杀茵能力超过10倍以上,(在各种介质下,对应杀灭的时间,残菌数量,对照得出的结论)。与现有ClO2杀茵能力按有效氯大于ClO2的2.6倍的数据有出入。
影响ClO2的杀菌能力的因素:
对它不良影响的是:Cl2或对应的ClO-离子,ClO2-、ClO3-
对它产生促进作用的是:溶解氧 H2O2,ClO2+离子,Cl-
对它没有影响的是:CO32-、Na+、Ca2+等离子
氯的氧化物:
a.Cl2O是黄棕色气体,在有还原剂或加热时会发生爆炸,溶于水生成次氯酸,是次氯酸的酸酐。
b.ClO2是红黄色气体,冷凝时为红棕色液体,易发生爆炸。大量制取的方法为:2NaClO3+SO2== 2ClO2+Na2SO4。ClO2与碱作用生成亚氯酸盐和氯酸盐:2ClO2+2NaOH==NaClO2+NaClO3+H2O。
c.Cl2O7是无色油状液体,受热或撞击立即爆炸。
氯的含氧酸及其盐的性质变化规律:

相关高中化学知识点:金属、非金属的有关计算
金属,非金属的相关计算:
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理:
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: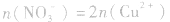
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/316580.html
相关阅读:在月球上制造氧气



