范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。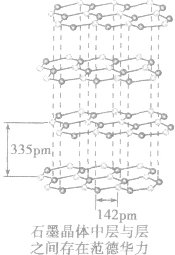
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点:  | 分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O  |
本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/472503.html
相关阅读:盘点2016年高考化学复习常见的4种纠错法



