金属硫化物:
(1)碱金属硫化物(Li----Cs)全部易溶于水。(硫化铵在低温下0度左右易溶于水,但是在常温下会逐渐分解为氨和硫化氢)
(2)碱土金属硫化物(除了Be)(Mg----Ba)易溶于水,但是同时完全水解为氢氧化物和硫氢化物。
(3)铝,铍,铬的硫化物全部水解为硫化氢气体和氢氧化物沉淀。
(4)FeS,ZnS,MnS,NiS,CoS不溶于水但溶于稀盐酸。
(5)Bi2S3,SnS,SnS2,PbS,CdS,Bi2S5等不溶于水和稀盐酸,只溶于浓盐酸。
(6)CuS,Cu2S,Ag2S不溶于水,稀盐酸,浓盐酸,只溶于浓硝酸。
(7)Hg2S,HgS不溶于水,浓稀盐酸,浓硝酸,只溶于王水。
金属硫化物的溶解性归纳:
1.溶于水的有: 等,由于
等,由于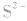 的水解,此类金属硫化物的水溶液显碱性:
的水解,此类金属硫化物的水溶液显碱性:
 。
。
2.不溶于水但溶于稀盐酸的有:FeS、ZnS、MnS等。如: 。
。
3.不溶于稀盐酸但溶于浓盐酸的有:Cds、SnS、PbS等。
4.不溶于浓盐酸但溶于硝酸溶液的有:CuS等。
5.仅溶于王水的有:HgS等。
注意: 遇水后,
遇水后, 都水解,且相互促进,反应方程式为
都水解,且相互促进,反应方程式为
 ,因而不能与水共存,只能在干态下制取。
,因而不能与水共存,只能在干态下制取。
硫的价态转化规律:
硫元素的价态比较多,常见的有-2、0、+4、+6 价,它们间的转化关系是:现将它们在化学反应中复杂的变化规律归结如下:
1.邻位价态转化规律
(1) 是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态(
是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态( )。
)。
(2)S能发生自身氧化还原反应(即歧化反应),在反应时分别升至和降至与其相邻的价态。如
(3) 处于中间价态,既有氧化性又有还原性。与弱氧化剂作用时,被氧化成相邻的高价态;与弱还原剂作用时,被还原成相邻的低价态。如
处于中间价态,既有氧化性又有还原性。与弱氧化剂作用时,被氧化成相邻的高价态;与弱还原剂作用时,被还原成相邻的低价态。如
(4) 是硫元素的最高价态,只有氧化性。遇到还原剂时,其价态一般降至相邻的价态(
是硫元素的最高价态,只有氧化性。遇到还原剂时,其价态一般降至相邻的价态( )。如
)。如
2.跳位转化规律
(1) 遇到强氧化剂时,价态会发生跳位转化。如
遇到强氧化剂时,价态会发生跳位转化。如
(2)反应条件改变时,硫的价态也会发生跳位转化。如
3.互不换位规律
(1) 发生氧化还原反应时,只能转化为中间价态,不可能互换位置。如
发生氧化还原反应时,只能转化为中间价态,不可能互换位置。如
(2)相邻价态的两物质问不发生氧化还原反应。  之间均不发生氧化还原反应。
之间均不发生氧化还原反应。
相关高中化学知识点:四氧化三铁
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
相关高中化学知识点:铁盐(三价铁离子)
Fe3+的性质:
含Fe3+的溶液都呈黄色,具有氧化性,
(1)与还原剂反应生成二价铁 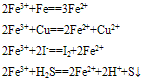
(2)与碱反应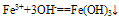
(3)Fe3+在水中易水解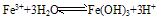
由于三价铁易水解,在保存铁盐盐溶液(FeCl3)时加入少量相应的酸(HCl),以防止Fe3+水解。
“铁三角”中的转化关系:

相关高中化学知识点:亚铁盐(二价铁离子)
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁

(2)与碱反应
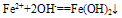
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/574310.html
相关阅读:2013福建高考命题组点评化学卷:重视读图基本功



