四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | ?? | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
相关高中化学知识点:单质钠
钠的基本性质:
钠元素的原子序数等于11,在周期表中位于第三周期,第ⅠA族。钠的原子结构示意图为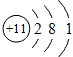 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
钠的物理性质:
钠单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
概括为:银白软轻低,热电良导体。
钠的化学性质:
钠的原子结构示意图为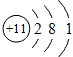 。
。
①与非金属单质的反应
A. 与氧气反应  (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)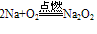 (淡黄色固体,较稳定)
(淡黄色固体,较稳定)
B. 与硫反应
2Na + S ==Na2S (研磨时发生爆炸)
C. 与氯气反应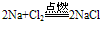
②与水反应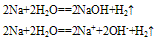
| 主要实验现象 | 对实验现象的分析 |
| 浮在水面上 | 密度比水小 |
| 熔化成闪亮的小球 | 反应放热,且钠的熔点低 |
| 迅速游动 | 反应产生气体(H2) |
| 嘶嘶作响 | 反应剧烈 |
| 溶液呈红色 | 反应生成NaOH,遇酚酞变红 |
③与盐溶液反应
钠与盐溶液反应,先考虑钠与水反应生成氢氧化钠,在考虑氢氧化钠是否与盐反应。
A. 投入NaCl溶液中,只有氢气放出。2Na+2H2O==2NaOH+H2↑
B. 投入饱和NaCl溶液中,有氢气放出,还有NaCl晶体析出(温度不变)。
C. 投入NH4Cl溶液中,有H2和NH3逸出。2Na+2NH4Cl==2NaCl+2NH3↑+H2↑
D. 投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2↓+H2↑
如何正确取用钠?
钠具有很活泼的化学性质,易与很多物质反应,所以在取用钠时一定要注意,千万不能直接用手去拿,以免手被腐蚀,实验剩余的钠屑,绝对不可以随意丢弃,而应放回到原瓶中。
正确做法:用镊子取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色。实验中剩余的钠必须放回原瓶。
钠露置在空气中的一系列变化:
Na→Na2O→NaOH→Na2CO3→Na2CO3?10H2O→Na2CO3
钠的保存、制取及用途 :
①保存:由于金属钠的化学性质非常活泼,易与空气中的氧气、水蒸气反应,所以钠要保存在煤油中。
②在实验室中钠块的取用:用镊子从试剂瓶中取出钠块,用滤纸吸净表面上的煤油,在玻璃片上用小刀切去表面的氧化层,再切下一小粒备用,余下的钠全部放回试剂瓶中。
③制取: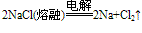
④用途:
A. 工业上用Na作还原剂,用与冶炼金属,如4Na+TiCl4 Ti+4NaCl
Ti+4NaCl
B. Na-K合金(液态)用作原子反应堆的导热剂。
C. 在电光源上,用钠制造高压钠灯。
焰色反应:
焰色反应是化学上用来测试某种金属是否存在在化合物的方法。其原理是每种元素都有其特别的光谱,显示出不同的颜色。
焰色反应的操作:
先准备一支铂丝,钴蓝玻璃及盐或其溶液。
把铂丝浸在浓盐酸中以清除先前余下的物质,再把铂丝放在酒精灯焰(蓝色火焰)中直至没有颜色的变化。
用蒸馏水或去离子水或纯水冲洗铂丝。
用铂丝接触盐或溶液,通过酒精灯焰(蓝色火焰)中加热。
当钠离子存在于所测试的溶液中,用钴蓝玻璃过滤钠离子的焰色。
最后将观察焰色。钠的焰色为明亮的金黄色火焰。
各种元素的颜色:
| 元素符号 | 离子元素 | 名称 | 焰色 |
| Ba | Ba2+ | 钡 | 黄绿 |
| Ca | Ca2+ | 钙 | 砖红 |
| Cs | Cs+ | 铯 | 浅紫 |
| Na | Na+ | 钠 | 黄 |
| Zn | Zn2+ | 锌 | 蓝绿 |
| Fe(III) | Fe3+ | 铁(III) | 金黄 |
| K | K+ | 钾 | 浅紫(透过蓝色钴玻璃) |
| Li | Li+ | 锂 | 深红 |
碱金属元素的性质:
1.氧化产物的特殊性。碱金属在空气中燃烧,只有Li氧化生成Li2O;其余的生成过氧化物(如Na2O2)或更复杂的氧化物(如KO2)。
2.碱金属单质密度都较小,其中锂的密度是所有金属中最小的。
3.碱金属单质熔点都较低,只有Li的熔点高于100℃。
4.钾、钠在常温下为固态,但钾钠合金在常温下为液态,可作为原子反应堆的导热剂。
5.碱金属单质通常保存在煤油中,但因锂的密度小于煤油而只能保存在液体石蜡中或封存在固体石蜡中。
6.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
7.试剂瓶中的药品取出后,一般不能放回原瓶,但ⅠA族金属Na、K等除外。
8.一般活泼金属能从盐中置换出不活泼金属,但非常活泼的金属Na、K等除外。
9.Fr是放射性元素,所以在自然界中不存在。
相关高中化学知识点:单质铝
铝的主要性质:
物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应:
 (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)(2)与Cl2 、S 、N2反应:
 (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)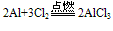
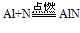 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑) (3)与水反应:

(4)与酸反应:
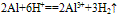
(5)与碱的反应:
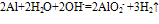
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe
铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示:
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 | 4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O | 2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) | 2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3?H2O+H2↑ Mg+Cu2+==Mg2++Cu | 2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:

Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
相关高中化学知识点:单质铁
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 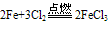
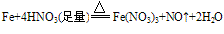
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 

③铁与氧气、水蒸气反应生成Fe3O4(FeO?Fe2O3)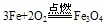

铁的性质:
物理性质:铁是黑色金属,具有铁磁性
铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
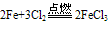
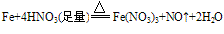
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如:


③铁与氧气、水蒸气反应生成Fe3O4(FeO?Fe2O3)
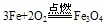

铁与稀硝酸的反应:
铁少量时:
铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。
铁三角关系:

相关高中化学知识点:金属的冶炼
金属的冶炼:
(1)把金属从化合态变为游离态。常用冶炼法:用碳一氧化碳氢气等还原剂与金属氧化物在高温下反应。
(2)冶炼的原理
①还原法:金属氧化物(与还原剂共热)--→游离态金属
②置换法:金属盐溶液(加入活泼金属)--→游离态金属
③火法冶炼(Pyrometallurgy)又称为干式冶金,把矿石和必要的添加物一起在炉中加热至高温,熔化为液体,生成所需的化学反应,从而分离出粗金属,然后再将粗金属精炼。
④湿式冶金(Hydrometallurgy) 湿法冶金这种冶金过程是用酸、碱、盐类的水溶液,以化学方法从矿石中提取所需金属组分,然后用水溶液电解等各种方法制取金属。此法主要应用在低本位、难熔化或微粉状的矿石。现在世界上有75%的锌和镉是采用焙烧-浸取-水溶液电解法制成的。这种方法已大部分代替了过去的火法炼锌。其他难于分离的金属如镍-钴,锆-铪,钽-铌及稀土金属都采用湿法冶金的技术如溶剂萃取或离子交换等新方法进行分离,取得显著的效果。
(3)常见金属冶炼:
①汞:热分解法:2HgO
 2Hg+O2(气体)
2Hg+O2(气体) ②铜:置换法:CuSO4+Fe==Cu+FeSO4(又叫湿法炼铜)
③铝:电解法:2Al2O3
 4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)
4Al+3O2(注意不能用AlCl3,因为AlCl3不是离子化合物)④镁:电解法:MgCl2(l)
 Mg(s)+Cl2(g)↑
Mg(s)+Cl2(g)↑ ⑤钠:电解法:2NaCl
 2Na+Cl2↑
2Na+Cl2↑ ⑥钾:原理是高沸点金属制低沸点金属:Na+KCl==K+NaCl(反应条件是高温,真空。)
⑦铁:热还原法:2Fe2O3+3C
 2Fe+3CO2↑
2Fe+3CO2↑ 炼铁和炼钢的比较:


铝的冶炼:
(1)由铝土矿制氧化铝
①将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中: 
②向偏铝酸钠溶液中通入二氧化碳,析出氢氧化铝: 
③使氢氧化铝脱水生成氧化铝:
(2)电解氧化铝制备铝
电解时,以氧化铝、冰晶石(Na2AlF6)熔融液为电解质,其中也常加入少量的氟化钙等帮助降低熔点;阳极和阴极以碳素材料做成,在电解槽的钢板和阴极碳素材料之间还要放置耐火绝缘材料。
①主要设备??电解槽
②电极反应式
阳极反应:
阴极反应:
总反应:
本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/743028.html
相关阅读:专家指导:2017年高考化学复习建议



