1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小。所谓价层电子对,指的是形成σ键的电子对和孤对电子。孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断ABn型共价分子或离子的空间构型。
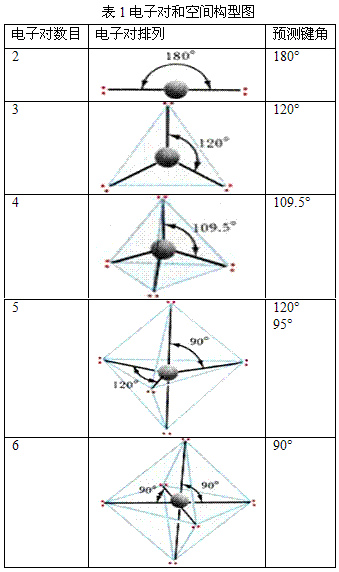
确定中心原子中价层电子对数:
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数。
规定:
①作为配体,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,亦当作1对电子处理。
⑤双键、叁键等多重键作为1对电子看待
判断分子的空间构型:
根据中心原子的价层电子对数,从表1中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。
相关高中化学知识点:杂化轨道理论(中心原子杂化方式)
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:

本文来自:逍遥右脑记忆 http://www.jiyifa.net/gaozhong/777975.html
相关阅读:家长经验分享:孩子考不出高分的原因



